Скорость элементарной реакции пропорциональна произведению концентраций реагирующих молекул. - раздел Образование, ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО Этот Закон Экспериментально Подтвердили В 1867 Г, Норвежские Учёные — Матем...
Этот закон экспериментально подтвердили в 1867 г, норвежские учёные — математик Като Максимилиан Гульдберг (1836—1902) и химик Петер Вааге (1833—1900), изучавшие обратимые реакции. Они доказали, что скорость реакций до установления равновесия пропорциональна «действующим массам» (как в то время называли концентрации) исходных веществ. Интересно, что Гульдберг и Вааге опубликовали свою работу на норвежском языке, и она оставалась незамеченной до тех пор, пока через 12 лет её не перевели на немецкий.
В зависимости от числа молекул, участвующих в элементарной реакции, закон действующих масс может иметь следующий вид:
w=k•[X] — для мономолекулярных,
w=k•[X]•[Y] — для бимолекулярных,
w=k•[X]•[Y]•[Z] — для тримолекулярных реакций.
Коэффициент пропорциональности k между скоростью и произведением концентраций называют константой скорости. Эта величина не зависит от концентраций, но на неё влияют температура и природа реагирующих веществ.
Сумму показателей степеней при концентрациях веществ называют общим порядком реакции. Показатели степеней при концентрациях в законе действующих масс равны единице только в случае элементарных реакций. Мономолекулярные реакции имеют первый порядок, бимолекуляр-
ЭКСПОНЕНТА И ГИПЕРБОЛЫ
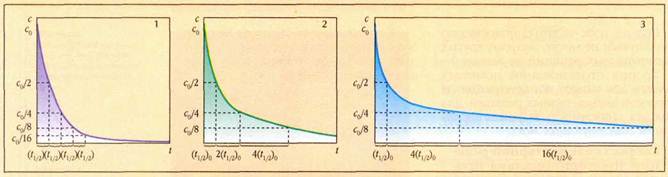
Зависимость концентрации реагента с от времени t для реакции первого порядка А®Р описывается формулой с=с0е-kt (с0 — начальная концентрация исходного вещества А, к — константа скорости реакции). Такая формула называется экспоненциальной, а соответствующая кривая — экспонентой (спадающей). Для реакции второго порядка А+®Р(в простейшем случае равенства концентраций реагентов А и В) скорость описывается уравнением w=dc/dt=-кс2 (знак «минус» показывает, что концентрация уменьшается со временем). Интегрирование этого уравнения дает иную зависимость концентрации реагента А (или В) от времени: 1/с-1/с0=kt, а соответствующая кинетическая кривая имеет гиперболическую зависимость (см. рисунок). Для реакций первого порядка период полупревращения t1/2 — величина постоянная: t1/2 =ln2/к.
А вот для реакций второго порядка период полупревращения зависит от исходной концентрации. Действительно, подставляя в формулу с=0,5с0 и t=t1/2, получим: t1/2=1/kc0. То есть по мере протекания реакции и уменьшения концентрации период полупревращения все время увеличивается.
Для реакции третьего порядка А+В+С ®Р зависимость скорости от концентрации, т. е. дифференциальная форма кинетического уравнения задаётся формулой w=dc/dt=-кс3 (при равных концентрациях всех исходных реагентов), а зависимость концентрации от времени (интегральная форма кинетического уравнения) описывается формулой 1/с2-1/с02=2kt. Время полупревращения для такой реакции равно 3/(2кс02). Кинетические кривые для реакций второго и третьего порядков приведены на рисунке.
Реакции второго и третьего порядков вначале могут идти быстро, но потом они резко замедляются, поскольку их скорость падает пропорционально соответственно квадрату и кубу концентрации. Это можно наглядно показать на таком примере. Пусть реакция считается законченной, когда израсходуется 99 % исходных веществ. Для реакции первого порядка время достижения 99-процентной степени превращения (когда с=0,01с0) равно -ln0,01/k, как нетрудно подсчитать по формуле с=c0e-kt. Следовательно, время окончания реакции больше времени полупревращения в
-ln0,01/ln2=6,4 раза. Реакция второго порядка закончится за время 99/кс0, что больше времени полупревращения уже в 99 раз. Для реакции же третьего порядка время её завершения равно 9999/2kc20, а это в 3333 раза больше, чем время полупревращения!
Поэтому когда реакция третьего (и вообще высокого) порядка проходит на значительную глубину, может показаться, что она перестала идти...
Все темы данного раздела:
ВЕЩЕСТВО И ЭЛЕКТРИЧЕСТВО
В конце XVIII в. итальянские учёные Луиджи Гальвани (1737—1798) и Алессандро Во'льта (1745—1827) создали первый химический источник тока. С этого открытия в истории цивилизации началась новая эра
Опыт Л. Гальвани. Гравюра. 1791 г.
объяснения. Прежде всего следовало ответить на вопрос: почему при замыкании цепи из двух металлических проводков лапка сокращается, какой раздражитель вызывает сокращения? Гальвани дал правильный
Вольтов столб. Чертёж из рукописи А. Вольта.
кружки цинковыми, а картон — сукном. В результате получилась удобная компактная батарея.
Вольта обнаружил, что при сочетании меди и цинка получаются «сильные» элементы, а из меди и сере
Гемфри Дэви.
ризонтально в сухих узких деревянных ящичках. Батарея состояла из трёхметровых рядов, соединённых последовательно медными скобками. Теоретически подобное устройство из 2100 мелно-цинковых пар мо
На катоде выделяется натрий, а на аноде — хлор.
МАЙКЛ ФАРАДЕЙ
(1791—1867)
Он не оканчивал университетов, этот гениальный само
Количество выделившегося при электролизе вещества пропорционально количеству пропущенного электричества и атомной массе с учётом валентности.
ЭЛЕКТРОХИМИЧЕСКИЙ СЧЁТЧИК
В наши дни количество израсходованной электроэнергии измеряет всем знакомый счётчик. Чем больше электричества пройдёт через него, тем больше оборотов сделает диск
Лаборатория М. Фарадея. Гравюра. XIX в.
Значение этого закона, совершенно чётко связывающего электричество с химическими свойствами веществ, трудно переоценить. Известный английский электрохимик, сконструировавший один из первых галь
Ряд напряжений металлов.
следующие, но ни один из предыдущих. Поскольку водород во многих отношениях близок к металлам, его тоже поместили в этот ряд — он оказался перед медью; однако сам водород металлы, как правило, н
ЭТИ ЗАГАДОЧНЫЕ КОЛЛОИДЫ
В середине XIX в. английский химик Томас Грэм (1805—1869) обнаружил вещества с загадочными свойствами. При выпаривании их растворов вместо кристаллов получались аморфные студенистые массы. Они име
Коллоидные растворы (золи) золота.
щелевой ультрамикроскоп, с помощью которого можно было разглядеть частицы диаметром менее 0,01 мкм. Они-то и выдвинули идею универсальности коллоидного, или дисперсного (от лат.
Центрифуга — аппарат для механического разделения смесей под действием центробежной силы.
ЭФФЕКТ РЕБИНДЕРА
На лекциях по коллоидной химии, которые замечательный советский химик, академик Пётр Александрович Ре'биндер (1898—1972) читал на химическом факультете МГУ, студентам де
Пётр Александрович Ребиндер.
к единице площади, характеризует поверхностное натяжение с. Вот почему коллоидные частицы обладают избытком энергии по сравнению с той же массой сплошного вещества. «Лишняя» энергия делает колло
Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
*Адсорбция (от лат. ad — «на», «при» и sorbeo — «поглощаю») — поглощение какого-либо вещества поверхностным слоем другого вещества.
Капли в аэрозолях и эмульсиях, пузырьки в жид
ТЕПЛО ХИМИЧЕСКИХ РЕАКЦИЙ
Важнейшая особенность химических процессов — образование новых веществ. Однако не менее важно и то, что они протекают с выделением или поглощением энергии. В первом случае реакции называются эк
И температуру, и крепость спиртных напитков измеряют в градусах.
Напоминания об этой теории сохранились даже в современном разговорном языке. Так, мы говорим, что теплота «течёт» от горячего тела к холодному, как будто речь идёт о жидкости. Слово «температура»
Эмануэль Клаузиус.
ЯЗЫК СОВРЕМЕННОЙ ТЕРМОДИНАМИКИ
Всякий объект, который изучает термодинамика, называется термодинамической системой. Система — это некоторая часть материального мира, ограниченная
Юлиус Роберт Майер.
«официальным» учёным, входящим в университетскую корпорацию. В конце концов Мор послал статью в Вену и... забыл о ней. Лишь спустя 30 лет он случайно обнаружил, что его работу всё-таки напечатали!
Джеймс Прескотт Джоуль
Позднее величина механического эквивалента теплоты несколько раз уточнялась. Джоуль в 1843 г. получил значение 460 кГм, американский физик Генри Август Роуланд (1848—1901) в 1880 г. — 427 кГм, ч
Герман Иванович Гесс.
КАК ИЗМЕРЯЮТ ТЕПЛОТУ
Количество теплоты измеряют по её переносу от одного тела к другому. Повышение температуры тела определяется его теплоёмкостью: С = Q/DT, где С — тепло
Живой организм — это тоже своего рода тепловая машина.
джоуль. Поскольку пища — разнородная смесь, её калорийность, как правило, приводят в виде средних значений в расчёте на 100 г.
Начало таким измерениям положили Антуан Лавуазье и Пьер С
БЫТЬ ИЛИ НЕ БЫТЬ РЕАКЦИИ? ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Едва ли найдётся другая научная теория, столь простая по своим основным идеям и столь универсальная по охвату разнообразных природных явлений и процессов, как термодинамика. Она объясняет плавле
Людвиг Больцман.
а воздух в комнате нагревается. Однако обратный процесс невозможен, хотя он и не противоречил бы первому закону.
Оказывается, правило таково: самопроизвольные процессы всегда сопровождаю
Невозможен самопроизвольный переход теплоты от холодного тела к горячему.
По-своему сформулировал этот закон в 1851 г. английский физик Уильям Томсон (лорд Кельвин): невозможна машина, которая «путём охлаждения моря или земли производила бы механическую работу в любом
Уильям Томсон, лорд Кельвин.
Как видим, формулировки Клаузиуса и Кельвина накладывают определённые ограничения на использование теплоты для производства работы и обосновывают невозможность создания вечного д
Вечный двигатель. Старинная гравюра.
Таким образом, изменение энтропии является однозначным критерием самопроизвольности реакции, протекающей в изолированной системе:
DS>0 — реакция протекает самопроизвольно;
Энтропия — царица хаоса.
реакция протекает с увеличением числа молей газов в системе, то энтропия системы возрастает, и наоборот. Например, энтропия сильно увеличивается в реакции СаСО3=СаО+СО2 и у
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
(CuОН)2СО3.
Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого м
Надрезанное яблоко на воздухе быстро покрывается коричневой плёнкой органических полиоксидов.
Эти формулы позволяют рассчитать среднюю скорость реакции за любой временной промежуток, если известна зависимость концентрации от времени. При стремлении At к нулю получае
Графическое определение скорости образования NO2 при распаде N2O5. В начале реакции скорость больше, чем в середине процесса.
ствии кислоты с образованием глюкозы и фруктозы. Для определения концентрации реагентов в разные моменты времени используют различные методы — химические и физические. Например, если химическая
Прибор для измерения скорости реакции растворения мела в уксусной кислоте.
значение имеет величина этой поверхности. Поэтому деревянные щепки сгорают быстрее полена такой же массы и металлические стружки растворяются в кислоте скорее, чем брусок.
Во многих слу
Механизм бимолекулярной реакции.
*Изомеризация — изменение строения без изменения состава молекулы.
ТЕОРИЯ СТОЛКНОВЕНИЙ
Если реакции протекают при столкновении молекул, то скорость реакций должна напрямую
Кинетические кривые для реакции первого (1), второго (2) и третьего (3) порядков.
ные — второй, тримолекулярные — третий. Часто «докопаться» до элементарной стадии химического процесса очень непросто, и общий порядок реакции устанавливают экспериментально, определяя вид зависи
Скорость сложной реакции пропорциональна произведению концентраций реагирующих молекул, возведённых в некоторые степени.
Например, для реакции А+®Рw=k[A]x[В]y. Показатели степени х и у, которые называют порядками по веществам А и В, в общем случае никак не связаны
При нагревании.
где g — температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при нагревании на 10 °С (или, что одно и то же, на 10 К).
Однако правило Вант-Гоффа спр
Энергетическая кривая, показывающая изменение энергии ядер в ходе химической реакции.
ПОЧЕМУ УСТАРЕЛО ПРАВИЛО
В школьных учебниках зависимость скорости реакции от температуры описывается правилом Вант-Гоффа. Однако в подавляющем большинстве изданий по физической химии это
Соотношение между энергией активации и температурой, при котором выполняется правило Вант-Гоффа.
В простейшей модели химической реакции атомные ядра представляют твёрдыми шариками, которые движутся по законам классической механики. Химики, изучая «шаг за шагом» сближение и взаимодействие мол
Полутяжёлая вода — вода, в состав молекулы которой входит один атом водорода и один атом дейтерия.
ОТ ИССЛЕДОВАНИЯ КИНЕТИКИ — К УПРАВЛЕНИЮ ХИМИЧЕСКИМИ РЕАКЦИЯМИ
Химия не только изучает окружающий мир, но и активно видоизменяет его, создавая новые материалы, процессы и реакции. В этом см
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
КОГДА РЕАКЦИЯ ОСТАНАВЛИВАЕТСЯ
Если смешать растворы кислоты и щёлочи, образуются соль и вода, например:
НСl+NaOH=NaCl+H2O. Если же попытаться провести реакцию хлорида
Анри Луи Ле Шателье.
РАССЧИТЫВАЕМ КОНЦЕНТРАЦИЮ КИСЛОТЫ
Константы равновесия определены для очень многих реакций. В большинстве случаев известно и то, как изменяется величина Кравн в з







Новости и инфо для студентов