рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Дополнение
Реферат Курсовая Конспект
Дополнение
Дополнение - раздел Химия, Тесты по химии Общая И Неорганическая Химия 1. ...
Общая и неорганическая химия
1. Соединение, в котором углерод имеет степень окисления - 4:
1. CO2;
2. CCl4;
3. CH4;
4. H2CO3.
2. Соединение, в котором азот имеет степень окисления + 3:
1. Cu(NO3)2;
2. NH4Cl;
3. N2O5;
4. Ca(NO2)2.
3. Кислород проявляет положительную степень окисления в соединении:
1. NaNO2;
2. KNO3;
3. H2O2;
4. OF2.
4. Водород проявляет отрицательную степень окисления в соединении:
1. HCl;
2. H2O;
3. NaH;
4. NaOH.
5. Степень окисления свинца одинакова в ряду:
1. PbCl4, Na2[Pb(OH)6], PbO;
2. Pb(NO3)2, PbO, Na2[Pb(OH)4];
3. Pb(OH)2, PbI2, Pb;
4. PbO2, Pb(CH3COO)2, Pb(OH)2 .
6. Соль, которой соответствует название "гидрокарбонат железа (II)":
1. Fe(HCO3)3;
2. Fe(HCO3)2;
3. FeOHCO3;
4. (FeOH)2CO3.
7. Соль, которой соответствует название "дигидроксосульфит алюминия":
1. (Al(OH)2)2SO4;
2. AlOHSO4;
3. Al(HSO3)3;
4. (Al(OH)2)2SO3.
8. Некоторый элемент Z образует хлорид состава ZCl5. Наиболее вероятная формула его оксида:
1. ZO2;
2. ZO5;
3. Z2O5;
4. Z5O2.
9. Оксид, образующий кислоту типа Н2ЭО3:
1. SO3;
2. CO2;
3. NO;
4. P2O5.
10.Даны простые вещества: сажа, озон, графит, кислород, алмаз, красный фосфор. Всего в состав этих веществ входит следующее количество химических элементов:
1. 6;
2. 3;
3. 4;
4. 5.
11.Массовая доля водорода будет наименьшей в соединении:
1. CH4;
2. C2H4;
3. C6H6;
4. C2H6 .
12.Ядовитый газ фосген имеет следующий элементный состав в массовых долях (%): C - 12,1; O - 16,2; Cl - 71,7. Его формула ___________ .
13.Оксид содержит 70,0 % железа. Формула этого оксида _________.
14.Атом кальция имеет электронную конфигурацию:
1. 1s22s22p63s23p64d2;
2. 1s22s22p63s2;
3. 1s22s22p63s23p64s2;
4. 1s22s22p63s23p63d104s2 .
15.Ион Al3+ имеет электронную конфигурацию:
1. 1s2;
2. 1s22s22p6;
3. 1s22s22p63s23p1;
4. 1s22s22p63s2.
16.Количество электронов, находящихся на внешнем энергетическом уровне атома кислорода: ___________ (впишите число).
17.К какому семейству элементов относится алюминий:
1. к семейству s-элементов;
2. к семейству p-элементов;
3. к семейству d-элементов;
4. к семейству f-элементов.
18.Из атомов двух элементов: водорода и гелия - меньший радиус имеет
1. атом водорода;
2. атом гелия;
3. размеры этих атомов одинаковы.
19.Электроотрицательность возрастает в ряду:
1. Te, Se, S, O;
2. Cl, F, S, O;
3. P, Si, S, O;
4. O, S, Se, Te.
20.Атомы изотопов одного элемента отличаются
1. числом протонов;
2. числом нейтронов;
3. числом электронов;
4. зарядом ядра.
21.Изотоп одного из элементов не содержит нейтронов. Речь идет о химическом элементе ___________ (впишите формулу).
22.В частице Na+ содержится ________ протонов (впишите количество протонов).
23.Молекула с неполярной ковалентной связью:
1. I2;
2. CO2;
3. HBr;
4. NH3.
24.В ряду молекул HCl - HBr - HI полярность ковалентной связи
1. усиливается;
2. уменьшается;
3. сначала усиливается, затем уменьшается;
4. остается практически неизменной.
25.Основная причина того, что температура кипения воды выше, чем температуры кипения сероводорода, теллуроводорода:
1. меньший радиус атома кислорода;
2. отсутствие d-орбиталей у атома кислорода;
3. наличие сильных водородных связей между молекулами воды;
4. меньшая молекулярная масса воды.
26.Тип гибридизации центрального атома и геометрическая форма молекулы аммиака:
1. sp2, треугольник;
2. sp3, тригональная пирамида;
3. sp3, тетраэдр;
4. sp2, тригональная пирамида.
27.Сравните плотность воды в жидком состоянии (dжид.) и в твердом состоянии (dтв.):
1. dжид. > dтв.;
2. dжид. < dтв.;
3. dжид. = dтв..
28.Ионную кристаллическую решетку имеет
1. фторид натрия;
2. вода;
3. серебро;
4. бром.
29.Молекулярную кристаллическую решетку имеет
1. алюминий;
2. оксид серы (IV);
3. хлорид калия;
4. графит.
30.Кристаллическая решетка алмаза
1. ионная;
2. атомная;
3. молекулярная;
4. металлическая.
31.Наибольшее число молекул содержится при обычных условиях в 1 литре
1. сероводорода;
2. воды;
3. водорода;
4. кислорода.
32.Ацетилен объемом 67,2 л при н.у. составляет следующее количество вещества:
1. 6 моль;
2. 2 моль;
3. 2,5 моль;
4. 3 моль.
33.Неверное утверждение:
1. водород не имеет запаха;
2. водород хорошо растворим в воде;
3. водород легче воздуха;
4. водород - бесцветный газ.
34.Несолеобразующим является оксид:
1. Al2O3;
2. CO2;
3. N2O;
4. Fe2O3.
35.В ряду находятся только кислотные оксиды:
1. Na2O, CaO, CO2;
2. SO3, CuO, CrO3;
3. SO3, CO2, P2O5;
4. SiO2, CO2, N2O .
36.Вещество, которое при растворении в воде дает слабощелочную реакцию:
1. NO2;
2. H2S;
3. CO2;
4. NH3.
37.Характер оксидов в ряду MnO - Mn2O3 - MnO2 - MnO3 - Mn2O7 изменяется
1. от кислотного к основному;
2. от основного к амфотерному;
3. от основного к кислотному;
4. все оксиды имеют примерно одинаковые свойства.
38.Реакция 3Fe + 2O2 Fe3O4 относится к реакциям
1. замещения;
2. обмена;
3. соединения;
4. разложения.
39.Реакция H2SO4 + 2NaOH Na2SO4 + 2H2O называется реакцией
1. окисления - восстановления;
2. гидролиза;
3. осаждения;
4. нейтрализации.
40.Реакцией замещения является
1. 3Fe + 2O2 Fe3O4;
2. Fe + 2HCl FeCl2 + H2;
3. 2Fe + 3Cl2 2FeCl3;
4. FeCl3 + 3AgNO3 Fe(NO3)3 + 3AgCl.
41.Не является электролитом
1. водный раствор серной кислоты;
2. расплав гидроксида натрия;
3. водный раствор сульфата меди (II);
4. жидкий кислород.
42.Кристаллогидратами называются
1. твердые вещества, в состав которых входит химически связанная вода;
2. твердые вещества, растворимые в воде;
3. твердые вещества, реагирующие с водой;
4. твердые вещества, не растворимые в воде.
43.Реакция, в которой окисляется водород:
1. CuO + H2 = Cu + H2O;
2. 2Na + H2 = 2NaH;
3. Mg + H2SO4 = MgSO4 + H2;
4. 
44.Галоген, в наибольшей степени проявляющий окислительные свойства: __________ (впишите формулу простого вещества).
45.В ряду увеличивается восстановительная способность галогенидов:
1. KCl, KBr, KI, KF;
2. KI, KBr, KCl, KF;
3. KF, KI, KBr, KCl;
4. KF, KCl, KBr, KI.
46.Причина того, что алюминий не подвергается коррозии:
1. химически малоактивен;
2. пассивируется в концентрированных H2SO4 и HNO3;
3. взаимодействует со щелочами;
4. покрыт защитной оксидной пленкой.
47.Опаснее всего подносить огонь к сосуду, в котором находится
1. азот;
2. кислород;
3. смесь водорода с кислородом;
4. водород.
48.Верное утверждение:
1. кислород имеет запах;
2. кислород хорошо растворим в воде;
3. кислород проводит электрический ток;
4. кислород тяжелее воздуха.
49.Вещество, не взаимодействующее с оксидом фосфора (V):
1. оксид углерода (IV);
2. оксид кальция;
3. гидроксид калия;
4. вода.
50.Реакция, с помощью которой нельзя получить оксид цинка:
1. Zn + HCl 
2. 
3. 
4. 
51.В уравнении реакции K2O + ZnO ; : сумма коэффициентов равна
1. 3;
2. 4;
3. 5;
4. 6.
52.В уравнении реакции SO3 + Al2O3 : сумма коэффициентов равна
1. 3;
2. 4;
3. 5;
4. 6.
53.Водород в промышленности получают следующим способом:
1. действием кислот на активные металлы;
2. разделением воздуха;
3. конверсией метана;
4. перегонкой нефти.
54.Для осушки аммиака его надо пропустить через
1. P2O5;
2. H2SO4 конц.;
3. NaOH;
4. CuSO4.
55.Качественный состав хлорида железа (III) можно установить, используя два раствора, содержащие соответственно ионы
1. CNS- и Ag+;
2. OH- и Ba2+;
3. CNS- и Ba2+;
4. OH- и H+.
56.Состав соли (NH4)2SO4 можно установить, используя два раствора, содержащие соответственно ионы
1. OH- и Ba2+;
2. OH- и H+;
3. Cl- и Cu2+;
4. CO32- и Ba2+.
57.Реакция, являющаяся качественной на ион SO42-:
1. SO3 + Ca(OH)2 = CaSO4 + H2O;
2. CuSO4 + Ni = NiSO4 + Cu;
3. Na2SO4 + BaCl2 = BaSO4 + 2NaCl;
4. 3Na2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6NaOH.
58.Имеются газы: H2S, Cl2, SO2, CO2. Реактив, являющийся лучшим поглотителем всех этих газов:
1. H2O;
2. раствор HCl;
3. H2SO4;
4. NaOH.
59.Выделение водорода будет наблюдаться в реакции:
1. Cu + H2SO4 (конц.)
2. Fe + H2SO4 (разб.)
3. Cu + HNO3 (конц.)
4. Fe + HNO3 (разб.) .
60.Ряд, в котором все вещества при добавлении воды образуют щелочи:
1. Na2O, Li, CaO, K;
2. Fe2O3, Li, CaO, Na;
3. Al2O3, CO2, Li, Fe2O3;
4. CaO, Na2O, Al2O3, Ca.
61.Ряд, в котором каждое из веществ образует с раствором щелочи осадок малорастворимого основания:
1. NaCl, FeCl3, Al2(SO4)3;
2. NH4Cl, CuSO4, MnCl2;
3. KNO3, Na2SO4, Cr(NO3)3;
4. CuSO4, FeCl3, Cr(NO3)3.
62.Ряд, в котором каждое из веществ реагирует с оксидом серы (IY):
1. H2O, SO3, NaCl;
2. H2O, O2, CaO;
3. Na2O, SiO2, H3PO4;
4. H2O, CaO, HCl.
63.Ряд, в котором каждое из веществ реагирует с молекулярным водородом:
1. HCl, NaCl, KOH;
2. Fe2O3, KOH;
3. Fe2O3, Cl2;
4. Fe2O3, KOH, Cl2.
64.Ряд, в котором каждое из веществ реагирует с хлороводородной кислотой:
1. Ca, H2, BaO;
2. Zn, H2O, BaSO4;
3. Al2O3, CO2, Cu;
4. MgO, Na2CO3, Fe.
65.Ряд, в котором каждый из металлов реагирует с разбавленной серной кислотой:
1. Na, Ag, Ba;
2. K, Ca, Ni;
3. Mg, Al, Pt;
4. Pb, Cr, Cu.
66.Ряд, в котором каждое из веществ взаимодействует с оксидом углерода (IV):
1. CaO, P2O5;
2. HCl, CaO;
3. NaCl, CaO;
4. Na2O, NaOH.
67.Ряд, в котором каждое из веществ вступает в реакцию с водным раствором карбоната натрия:
1. HNO3, CO2;
2. NaCl, CaCO3;
3. CO2, NaOH;
4. O2, Ba(NO3)2.
68.Ряд, в котором каждый из оксидов пригоден для использования в качестве осушителя (поглотителя воды):
1. CuO, P2O5;
2. BaO, CuO;
3. P2O5, BaO;
4. Fe3O4, P2O5.
69.Ряд, в котором каждое из веществ можно использовать для получения кислорода лабораторным способом:
1. KMnO4, H2SO4, NaCl;
2. NaNO3, Ba(OH)2, Al2O3;
3. HgO, Ba(OH)2, NaNO3;
4. KMnO4, H2O2, KClO3.
70.Ряд, в котором каждое из веществ несовместимо с присутствием озона:
1. SO2, CO2, H2S, HF;
2. SO2, H2S, H2, HF;
3. KJ, SO3, CO2, N2;
4. SO2, H2S, KJ, N2.
71.На чашках весов уравновешены стаканчики с растворами гидроксида натрия и хлорида натрия. Через некоторое время стрелка весов

1. отклонится влево;
2. отклонится вправо;
3. не изменит своего положения.
72.Вещество, с которым взаимодействует сульфид натрия с образованием PbS:
1. Pb;
2. PbO;
3. Pb(NO3)2;
4. PbO2.
73.Реагент(ы), в реакции с которым(и) оксид азота (IV) образует только нитрат натрия и воду:
1. NaOH, Ca;
2. Na2S;
3. Na2SO4;
4. NaOH, O2.
74.Продукты, образующиеся при термическом разложении нитрата меди (II):
1. Cu(OH)2, O2, N2;
2. CuO, NO2, O2;
3. CuO, NO2;
4. Cu(NO3)2, O2.
75.Кислота, которую нельзя хранить ни в обычной посуде, ни в посуде из кварцевого стекла:
1. HNO3;
2. H2SiO3;
3. HBr;
4. HF.
76.В трех пробирках находятся растворы хлорида калия, бромида калия и иодида калия. Реактив, с помощью которого можно распознать все соли:
1. H2SO4;
2. HCl;
3. AgNO3;
4. AgCl.
77.В трех пробирках находятся концентрированные растворы кислот: H2SO4, HCl, HNO3. Реактив, с помощью которого можно распознать все кислоты:
1. BaCl2;
2. метиловый оранжевый;
3. Zn;
4. AgNO3.
78.Смесь железа, меди и алюминия обработали концентрированной азотной кислотой на холоду. При этом растворились следующие металлы:
1. Fe, Cu;
2. Все металлы;
3. Fe, Al;
4. Cu.
79.Масса стакана с концентрированной серной кислотой при длительном хранении
1. увеличится;
2. уменьшится;
3. не изменится.
80.Из перечисленных процессов:
1. а) растворение концентрированной серной кислоты в воде;
2. б) испарение спирта;
3. д) разложение воды
4. в) гашение извести;
5. г) горение водорода;
к экзотермическим относятся
6. а, в, г;
7. а, б, в, г, д;
8. б, д;
9. а, в, г, д.
81.В реакционной системе в равновесии находятся
 .
.
Чтобы сместить равновесие реакции вправо, необходимо
1. увеличить концентрацию CO2;
2. увеличить давление в системе;
3. повысить температуру;
4. уменьшить концентрацию O2 .
82.Химическое равновесие в системе

сместится в сторону исходных веществ при
1. понижении температуры;
2. повышении температуры;
3. повышении давления;
4. перемешивании.
83.Реакция, для которой повышение давления в системе приводит к увеличению выхода продукта реакции:
1.  ;
;
2.  ;
;
3.  ;
;
4. 
84.В 200 мл воды растворили 25 г соли. Массовая доля соли в полученном растворе составляет
1. 11,1%;
2. 12,5%;
3. 50%;
4. 1,25% .
85.При растворении кристаллогидрата CaCl2 · 6 H2O массой 219 г в 1000 г воды образовался раствор хлорида кальция с массовой долей
1. 9,1%;
2. 17,9%;
3. 21,9%;
4. 43,8% .
86.Реакция, протекающая без изменения степеней окисления:
1. P + O2 ;
2. CaO + H2O ;
3. Fe + H2SO4 ;
4. MnO2 + 4 HCl .
87.В реакции, протекающей по схеме Cr2S3 + KNO3 K2CrO4 + K2SO4 + NO, окислению подвергаются следующие элементы:
1. N, S;
2. S, Cr;
3. Cr, N;
4. Cr, O .
88.Реакция, в которой фосфор выполняет роль окислителя:
1. 4P + 5O2 = 2P2O5;
2. P + 3K = K3P;
3. 2PH3 + 4O2 = P2O5 + 3H2O;
4. 2P + 5Cl2 = 2PCl5;
89.Реакция, протекающая практически до конца:
1. CuSO4 + KOH ;
2. NaCl + KOH ;
3. CuSO4 + HCl ;
4. BaSO4 + HCl .
90.Реакция, которую можно использовать для получения гидроксида алюминия:
1. Al2O3 + H2O ;
2. AlCl3 + NaOH (недостаток) ;
3. AlCl3 + NaOH (избыток) ;
4. Al + NaOH (избыток) .
91.Вещества, в водных растворах которых растворяется Al(OH)3:
1. KOH, H2SO4;
2. NaOH, NaCl;
3. NaNO3, KCl;
4. H2SO4, K2SO4.
92.Из приведенных ниже солей гидролизу не подвергается
1. CuSO4;
2. Na2CO3;
3. CH3COONH4;
4. KNO3 .
93.В водном растворе кислую реакцию среды имеет
1. CH3COONa;
2. NH4Cl;
3. Na2CO3;
4. Na2HPO4 .
94.Ряд, в котором водный раствор каждого из указанных веществ имеет щелочную реакцию среды:
1. NaHCO3, NaCl;
2. NaOH, K2CO3;
3. KNO3, KOH;
4. Na2SO4, Na2S.
95.Чтобы ослабить или прекратить гидролиз раствора хлорида железа (III), необходимо немного добавить
1. соляной кислоты;
2. гидроксида калия;
3. твердой соли NaCl;
4. дистиллированной воды.
96.Вещество, которое выпадает в осадок при сливании концентрированных водных растворов Na2S и AlCl3:
1. Al2S3;
2. Al(OH)3;
3. AlOHCl2;
4. NaCl .
97.При взаимодействии образца кристаллической соды массой 1,287 г с избытком хлороводородной кислоты выделилось 100,8 мл газа (н.у.). Формула кристаллогидрата имеет вид:
1. Na2CO3 · 10 H2O;
2. Na2CO3 · 7 H2O;
3. Na2CO3 · H2O;
4. Na2CO3 .
98.При получении меди из сульфата меди (II) необходимо осуществить ряд превращений CuSO4 X Y Cu, промежуточными продуктами которых будут X __________ , Y ___________ (впишите формулы веществ).
99.Превращения 
можно осуществить с помощью следующих реагентов:
1. X - HСl, Y - AgNO3;
2. X - MgCl2, Y - Ba(NO3)2;
3. X - KCl, Y - NaNO3;
4. X - Cl2, Y - HNO3.
100. Превращения 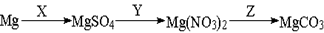
можно осуществить с помощью следующих реагентов:
1. X - K2SO4, Y - HNO3, Z - H2CO3;
2. X - BaSO4, Y - HNO3, Z - CaCO3;
3. X - Na2SO4, Y - KNO3, Z - H2CO3;
4. X - H2SO4, Y - Ba(NO3)2, Z - Na2CO3.
101. Превращения 
можно осуществить с помощью следующих реагентов (процессов):
1. X - электролиз раствора, Y - KOH, Z - BaSO4;
2. X - электролиз расплава, Y - H2O, Z - H2SO4;
3. X - C, Y - H2O, Z - K2SO4;
4. X - C, Y - KOH, Z - CaSO4.
102. Масса гидроксида кальция, которую следует прибавить к 162 г 25 %-ного раствора гидрокарбоната кальция для получения средней соли:
1. 3,7 г;
2. 18,5 г;
3. 1,0 г;
4. 10,0 г.
103. При растворении в воде объемом 120 мл оксида фосфора (V) в количестве 0,2 моль получился раствор ортофосфорной кислоты с массовой долей
1. 0,26;
2. 0,24;
3. 0,22;
4. 0,20.
104. Смесь оксидов меди (II) и железа (III) массой 95,5 г восстановили водородом. При действии на продукты избытка хлороводородной кислоты выделилось 4,48 л водорода (н.у.). Масса меди, образовавшейся при восстановлении:
1. 45 г;
2. 32 г;
3. 64 г;
4. 30 г.
105. При пропускании электрического тока через воду образовалось 3,36 л кислорода (н.у.). Количество воды, подвергшейся разложению, составляет
1. 0,15 моль;
2. 13,3 моль;
3. 1 моль;
4. 0,3 моль.
106. При полном восстановлении оксида меди (II) массой 79,5 г водородом образовалась металлическая медь массой
1. 32,75 г;
2. 63,5 г;
3. 79,5 г;
4. 159,0 г.
107. Образец стали массой 5 г при сжигании в токе кислорода дал углекислый газ массой 0,1 г. Массовая доля углерода в стали составляет
1. 0,55 %;
2. 2,0 %;
3. 1,1 %
4. 1,0 % .
108. Объем оксида углерода (IY) (н.у.), необходимый для получения Ca(HCO3)2 из 7,4 г Ca(OH)2, составляет
1. 2,24 л;
2. 3,36 л;
3. 4,48 л;
4. 5,6 л .
109. При взаимодействии кремния с водным раствором NaOH выделилось 3,36 л H2 (н.у.). В реакции использовался технический кремний, содержащий 10% примесей. Его масса, потребовавшаяся для проведения реакции, равна
1. 2,3 г;
2. 1,3 г;
3. 3,0 г;
4. 1,0 г.
110. В алюмотермическом процессе из оксида железа (III) массой 32 г образовалось железо массой 20 г. Практический выход железа от теоретического составил
1. 90,2%;
2. 89,3%;
3. 75,8%;
4. 70,4%.
111. При восстановлении железа из оксида железа (III) алюминием образовалось железо массой 224 г. При этом количество вещества алюминия, вступившего в реакцию, составило
1. 4 моль;
2. 2 моль;
3. 6 моль;
4. 12 моль.
112. Количество вещества и масса гидроксида натрия, необходимые для нейтрализации 14,6%-ного раствора хлороводородной кислоты массой 300 г, равны соответственно
1. 1,2 моль, 40 г;
2. 1,5 моль, 60 г;
3. 1,2 моль, 48 г;
4. 1,5 моль, 48 г.
113. В эвдиометре взорвали смесь, состоящую из 4 мл водорода и 6 мл кислорода. Газ, оставшийся после взрыва, представляет собой _____ (впишите химическую формулу газа) и имеет объем
1. 6 мл;
2. 4 мл;
3. 2 мл.
4. оба газа прореагировали без остатка.
114. В стакан с 60 г 10%-ного раствора хлороводородной кислоты насыпали 9,2 г железных опилок и оставили стоять без доступа воздуха. На следующий день обнаружили, что в стакане образовалось вещество состава
1. FeCl3;
2. FeCl2;
3. FeOHCl;
4. Fe(OH)2Cl.
115. Вещества, которые можно использовать для устранения общей жесткости воды:
1. Na3PO4, Na2CO3;
2. известковая вода, H2SO4;
3. Na2CO3, SO2;
4. NaOH, HCl.
116. Временная жесткость воды обусловлена присутствием в воде
1. Ca(HCO3)2, Mg(HCO3)2;
2. NaHCO3, KHCO3;
3. CaCO3, MgCO3;
4. Na2CO3, K2CO3.
117. Карбонатная жесткость проявляется в результате следующих природных процессов:
1. при взаимодействии известковой почвы с почвенной и дождевой водой, насыщенной атмосферным диоксидом углерода (IV);
2. при взаимодействии карбонатов с природными кислотами;
3. при растворении гипса в воде;
4. при химических реакциях, происходящих в почве.
118. В результате превращений

образуется конечный продукт (X3) состава
1. KCrO2;
2. K2CrO4;
3. K2Cr2O7;
4. Cr2(SO4)3 .
119. Одну из двух одинаковых порций гидрокарбоната натрия NaHCO3 прокалили, а затем обе порции раздельно обработали избытком хлороводородной кислоты. В каком случае и во сколько раз объем газа, образовавшегося при действии кислоты, больше? Правильным утверждением является следующее:
1. в случае обработки кислотой прокаленной порции - в 2 раза;
2. в случае обработки кислотой непрокаленной порции - в 2 раза;
3. в обоих случаях выделится одинаковый объем газа.
120. Подберите коэффициенты в уравнении окислительно-восстановительной реакции
K2SO3 + H2SO4 + KMnO4 MnSO4 + K2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов _______.
121. Подберите коэффициенты в уравнении окислительно-восстановительной реакции Na2Cr2O7 + H2SO4 + NaBr Cr2(SO4)3 + Br2 + Na2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов _________.
122. Подберите коэффициенты в уравнении окислительно-восстановительной реакции FeCl2 + HCl + KMnO4 - FeCl3 + Cl2 + MnCl2 + KCl + H2O. В ответе укажите в уравнении сумму коэффициентов ______.
123. Уравнение окислительно-восстановительной реакции, в котором правильно подобраны коэффициенты:
1. H2SO4 + H2S = 2H2O + SO2 + S;
2. 4H2SO4 + 2H2S = 6H2O + 5SO2 + S;
3. 2H2SO4 + 4 H2S = 6H2O + SO2 + 5S.
124. При полном электролизе раствора хлорида натрия с платиновыми электродами получится раствор, содержащий
1. PtCl2;
2. NaOH;
3. HCl;
4. H2O.
125. В процессе электролиза водного раствора NaClO4 на электродах выделятся следующие продукты:
1. Na, Cl2;
2. H2, Cl2, O2;
3. H2, O2;
4. H2, O2, Na.
126. При электролизе расплава хлорида натрия на аноде выделилось 56 л хлора. Масса образовавшегося металлического натрия равна
1. 115 г;
2. 100 г;
3. 120 г;
4. 2 моль.
127. Имеется раствор смеси солей: Na2SO4 и CuSO4. При электролизе этого раствора на катоде будут выделяться следующие вещества в указанной последовательности:
1. Cu, H2;
2. Cu, Na;
3. H2, Na;
4. Cu, O2.
128. Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом выделилось 5,6 л (н.у.) газа. Нерастворившийся остаток отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Массовая доля (%) меди в сплаве составляет
1. 69%;
2. 74%;
3. 61%;
4. 25%.
129. При взаимодействии смеси железных и медных опилок с разбавленной серной кислотой выделилось 8,96 л газа (н.у.). При обработке такого же образца концентрированной азотной кислотой образовалась соль, при термическом разложении которой выделилось 11,2 л газа (н.у.). Процентное содержание меди в сплаве составляет
1. 46,8%;
2. 36,4%;
3. 57,6%;
4. 18,2%.
130. При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. Химическая формула металла ______.
131. Растворимость хлорида натрия при 25 С составляет 36,0 г в 100 г воды. Массовая доля соли в насыщенном растворе при этой температуре равна
1. 9,5%;
2. 5,0% ;
3. 26,47% ;
4. 36%.
132. Смешали 100 г 10%-ного раствора хлороводородной кислоты и 100 г 10%-ного раствора гидроксида натрия. Массовая доля хлорида натрия в образовавшемся растворе составляет
1. 7,31%;
2. 16,21%;
3. 14,62%;
4. 10%.
133. Какова должна быть массовая доля хлороводорода в соляной кислоте, чтобы в ней на 10 моль воды приходился 1 моль хлороводорода?
1. 10%;
2. 16,86%;
3. 25%;
4. 8,43%.
134. В воде растворили 11,2 г гидроксида калия. Объем раствора довели до 257 мл. Какова молярная концентрация раствора?
1. 0,78 моль/л;
2. 4,4 моль/л;
3. 0,5 моль/л;
4. 0,2 моль/л.
135. Какую массу медного купороса CuSO4 · 5H2O и воды надо взять для приготовления 40 кг 20%-ного раствора сульфата меди (II)?
1. 8 кг CuSO4 · 5 H2O, 32 кг H2O;
2. 10 кг CuSO4 · 5 H2O, 30 кг H2O;
3. 12,5 кг CuSO4 · 5 H2O, 27,5 кг H2O.
ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ
I - номера тестовых заданий, II - номера правильных ответов
| I | II | I | II | I | II | I | II | I | II |
| O2, 2 | |||||||||
| F2 | |||||||||
| COCl2 | |||||||||
| Fe2O3 | |||||||||
| H | |||||||||
| Ca | |||||||||
| Cu(OH)2 CuO | |||||||||
Составлять тесты исходя из следующего:
1.В тесте 20 вопросов
2.Из девяти тем включать по 2 или 3 вопроса и из дополнения оставшиеся до 20
Размещено на Allbest.ru
– Конец работы –
Эта тема принадлежит разделу:
Тесты по химии
гидроксид калия... Количественно процессы электролиза подчиняются законам... Ньютона...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Дополнение
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов