рефераты конспекты курсовые дипломные лекции шпоры
Реферат Курсовая Конспект
ОПРЕДЕЛЕНИЕ АТОМНЫХ МАСС
ОПРЕДЕЛЕНИЕ АТОМНЫХ МАСС - Лекция, раздел Химия, Лекция № 1-2 Тема лекции: Введение. Основные понятия и законы химии 1. Метод Каницарро Этот Метод Пригоден Для Определен...
1. Метод Каницарро
Этот метод пригоден для определения атомных масс элементов, образующих летучие соединения. Для этого необходимо определить молекулярные массы нескольких летучих соединений данного элемента, найти их процентный состав и вычислить долю от молекулярной массы, которая приходится на данный элемент. Так как элемент не может быть представлен в своих соединениях меньше, чем одним атомом, то наименьшая доля от молекулярной массы, которая приходится на данный элемент в различных соединениях, и будет его атомной массой. Например:
| Соединение | Молекулярная масса | Содержание углерода | |
| % | в.ч. | ||
| СО2 | 23,7 | ||
| СН4 | |||
НС СН СН
| 92,3 | ||
| С6Н6 | 92,3 |
Расчет весовых частей (в.ч.) - последняя колонка, проводится по пропорции:
а) 23,7(%) "С" - 100 г в-ва х = 44 . 23,7 = 12
х - 44 100
б) 75 - 100 х = 16 . 75 = 12 и т.д.
х - 16 100
2. Определение атомных масс на основании закона Дюлонга и Пти (правило Дюлонга и Пти).
Изучая теплоемкость металлов французские ученые Дюлонг и Пти в 1819 году открыли следующую закономерность, согласно которой:
произведение удельной теплоемкости простого вещества в твердом состоянии на атомную массу соответствующего элемента является величиной приблизительно постоянной и равной в среднем 6,4 кал/г-ат . град.
Так как это произведение представляет собой количество тепла, необходимое для нагревания I грамм-атома элемента на 1°С, то оно называется атомной теплоемкостью:
А • с = 6,4 где
6,4 - атомная теплоемкость;
А - атомная масса элемента;
с - удельная теплоемкость.
Отсюда: А = 6,4/с
Удельную теплоемкость (с) легко определить экспериментально, поэтому разделив 6,4 на удельную теплоемкость, можно определить приблизительно значение атомной массы соответствующего элемента. Ее (атомную массу) уточняют с помощью эквивалента элемента, который определяют на основании химического анализа соединений данного элемента с водородом или кислородом. Между эквивалентом элемента и его атомной массой (весом) существует следующее соотношение: атомная масса (вес) элемента всегда является величиной, кратной его эквиваленту, т.е. или равяняется эквиваленту, или в целое число раз больше его.
Рассматривая закон эквивалентов, мы видим, что вещества взаимодействуют между собой не в любых, а в строго определенных (эквивалентных) количествах. Т.е. атомы одного простого вещества при взаимодействии с атомами .другого простого вещества образуют молекулы сложного вещества строго определенного состава, в котором на один атом одного элемента приходится строго определенное количество .другого элемента. Точно так же один атом одного элемента может заместить в сложном веществе тоже только вполне определенное количество атомов другого элемента. Отсюда и возникло первоначальное понятие о валентности.
Валентность выражается числом, показывающим способность атомов одного элемента присоединять или замещать строго определенное количество атомов другого элемента.
Мерой валентности является валентность атома водорода, принятая за единицу.
Между эквивалентом, валентностью и атомной массой справедливо такое
соотношенве: Э = А/В или В = А/Э или' А = Э . В
Пользуясь этой зависимостью, нетрудно установить точную атомную массу элемента, если известна его приблизительная атомная масса и эквивалент.
Пример №1: Оксид содержит 78,7% металла и 21,3% кислорода. Удельная теплоемкость металла с = 0,05. Вычислить его атомную массу.
Решение: 1. По правилу Дюлонга и Пти определяем приближенное значение атомной массы: А = 6,4/0,05 == 128
2. Исходя из %-ного содержания оксида и пользуясь законом эквивалентов, определяем эквивалент металла:
78,7/21,3 = ЭМе/8; ЭМе = 8.78,7/21,3 = 29,56
3. Определяем валентность элемента, руководствуясь правилом, что валентность не может быть дробной величиной:
В = А/Э = 128/29,56 = 4.
4. Определяем точную атомную массу металла: А = Э . В = 29, 56 . 4 = 118, 24
Определение химических формул
Химическая формула выражает собой количественный и качественный состав простого вещества или химического соединения, а также соотношение между числом атомов элемента, которые входят в данное соединение.
Зная формулы химических соединений, можно выполнять различные расчеты. По количеству атомов и атомными массами элементов, которые входят в состав соединения, можно, например, рассчитать ее молекулярную или формульную массу, %-ное содержание того или иного элемента. Каждая химическая формула есть не только качественным, а и количественным показателем соединения или простого вещества. Это особенно касается написания химических уравнений. До сформулирования закона Авогадро существовало большое число заблуждений при написании химических формул. Поскольку не существовало общепринятых атомных мас, то каждый химик руководствовался теми соображениями, которые ему казались наиболее вероятными. Все недоразумения относительно правильного написания химических формул быстро отпали, как только был использованы методы нахождения атомных и молекулярных масс.
Пример: Соединение углерода, серы, азота и водорода содержит 15,79% углерода, 42,11% - серы, 36,84% азота и 5,74% - водорода. Для определения его формулы сначала рассчитываем атомные частицы элементов и соотношение между ними:
15,79/12:41,63/32:36,84/14:5,74/1 = 1,316:1,316:2,631:5,741 = 1:1:2:4. Это соответствует простейшей формуле тиомочевины СSN2Н4. Молекулярная масса этого соединения составляет 76, т.е. подобна формульной массе, а поэтому приведенная выше формула есть молекулярной.
Структурные формулы и закон Бутлерова. Из исследований веществ, состоящих из серы, углерода, азота и водорода, видно, что формулу СSN2Н4 имеют два соединения - тиомочевина и роданид аммония (аммония тиоцианат). Возникает вопрос, что должно отличать эти соединения, когда их количественный и качественный состав одинаковый. Так как по закону простых весовых отношений индивидуальность вещества характеризуется ее определенным составом.
Великий русский химик Бутлеров впервые заметил, что индивидуальность веществ, природа соединения зависит и от того, как соединены атомы элементов между собой, т.е. от строения ее молекулы. Строение молекулы можно выразить только структурными формулами, в которых показана не только общее количество атомов в молекуле, но и порядок их соединения. В этих формулах связи между атомами изображаются с помощью рисок (одна риска указывает на одну валентную связь между атомами, две риски соответствуют двойной связи и т.д.). Таким образом, кроме простейшей и молекулярных формул, в химии, особенно органической, приходится иметь дело еще и со структурными формулами. Тиомочевина и тиоцианат аммония, несмотря на одинаковый количественный и качественный состав, имеют разные структурные формулы:
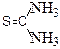 NH4-N=C=S
NH4-N=C=S
Примеры, когда одной молекулярной формуле соответствует больше одного соединения, известно много. Впервые они были выявлены и обоснованы Бутлеровым еще в 60-х годах прошлого столетия.
В 1861 году Бутлеров сформулировал закон, который назвал его именем и в дальнейшем положен в основу теории химического строения вещества. Содержание этого закона можно выразить следующим образом:
1. Свойства химических соединений зависят не только от качественного и количественного их состава, но и от порядка расположения атомов в молекуле или кристалле;
2. Каждому соединению соответствует, определенная, только ей характерная структура;
3. Когда одной молекулярной или простейшей формуле соответствует две или больше структурных, которые принадлежат определенным реальным соединениям, то такое явление называется изомерией. Каждое из отдельных соединений называется изомерами.
Закон Бутлерова сыграл великую роль при исследовании и в поиске новых химических соединений. Благодаря ему в конце XIX и в начале XX веков было достигнуто значительное количество грандиозных успехов в органическом синтезе.
– Конец работы –
Эта тема принадлежит разделу:
Лекция № 1-2 Тема лекции: Введение. Основные понятия и законы химии
Тема лекции Введение Основные понятия и законы химии... План лекции Предмет задачи и методы химии...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОПРЕДЕЛЕНИЕ АТОМНЫХ МАСС
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов