рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- По Теоретической электрохимии
Реферат Курсовая Конспект
По Теоретической электрохимии
По Теоретической электрохимии - раздел Философия, Экз. N1 Лабораторный Практик...
экз. N1
Лабораторный практикум
по Теоретической электрохимии
Кинетика электродных процессов
Москва
Содержание
1. Описание и работа прибора 3
1.1. Назначение прибора 3
1.2. Устройство и принцип работы 3
2. Подготовка прибора к использованию 5
3. Эксплуатация прибора 5
3.1. Основные схемы включения прибора 5
3.2. Работа с программным обеспечением 6
3.3. Основные режимы работы потенциостата 9
3.4. Сохранение и перенос данных в MS Excel 15
4. Работа 1. Диффузионное перенапряжение 16
5. Работа 2. Перенапряжение при выделении водорода 21
6. Работа 3. Определение коэффициентов диффузии ионов и нейтральных
молекул с помощью вращающегося дискового электрода 32
7.Работа 4. Исследование нестационарной диффузии хронопотенциометрическим
методом 37
Описание и работа прибора
Назначение прибора
Основные функции прибора: • измерение вольтамперных характеристик; • электрохимические измерения (полярография, кулонометрия);Устройство и принцип работы
На передней панели прибора находятся разъемы для подключения образца и заземления, индикатор включения питания “Power”; на задней панели – кнопка и… Рис. 1. Потенциостат «P-30»: (а) – внешний вид прибора, (б) – передняя панель, (в) – задняя панель. Обозначения: 1 –…Подготовка прибора к использованию
Затем проведите внешний осмотр прибора, при котором проверьте: - сохранность пломб;Эксплуатация прибора
Основные схемы включения прибора
В данном приборе реализуются три основных способа подключения к исследуемому объекту (электрохимической ячейке): двух-, трех- и четырехэлектродная схемы (рис. 2). Во всех случаях токовыми электродами являются “Counter” и “Work”, а соответствующими потенциальными – “Ref” и “Comp”.
Во всех случаях прибор стабилизирует величину сигнала электрода “Comp” относительно электрода “Ref” (касательно системы знаков напряжений; положительному напряжению (потенциалу) при этом соответствует положительный ток).

Рис. 2. Подключение по двух- (а), трех- (б) и четырехэлектродной (в) схемам
Работа с программным обеспечением
Программа PS_Pack, поставляемая в комплекте с прибором, предназначена для полного управления работы с ним.
После запуска программы PS_Pack (необходимо запустить файл PS_Pack.exe) на рабочем столе появляется окно (рис. 3), в левом верхнем углу которого расположены два основных меню: «Файл» и «Установки».
 Внимание!
Внимание!
При запуске программы с неподключенным прибором (либо некорректно выбранным портом) некоторые меню программы (диапазоны) будут не заполнены и не дадут возможности работы с прибором ввиду того, что они определяются, исходя из идентификаторов прибора после соединения с ним и загрузки в программу калибровок из прибора на стадии запуска программы. Поэтому рекомендуется запускать и работать с программой уже при подключенном и включенном приборе.
Рис. 3. Внешний вид программы PS_Pack после запуска
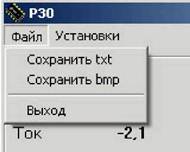
При активации меню «Файл» (рис. 4(а)) появляется возможность сохранения результатов после проведения эксперимента.
Полученные данные можно сохранить в текстовом файле, выбрав опцию «Сохранить txt», либо в графическом формате ВМР, выбрав опцию «Сохранить bmp». Опция «Выход»осуществляет выход и закрытие программы. При сохранении результатов измерения в графическом режиме вид графика будет такой же, как и у окна «Р8-диаграмма» (рис. 5), поэтому перед сохранением следует выбрать нужный тип этого графика.

(а) (б)
Рис. 4. Окна программы PS_Pack при активации меню «Файл» (а) и «Установки» (б)

Рис. 5. Окно вывода результатов измерений в графическом режиме
В разделе меню «Установки» (рис. 4(б)) при активации опции «Настройки» появляется окно (рис. 6), в котором устанавливается скорость регистрации точек. Базовая скорость регистрации 105 точек в секунду. Также в этом окне можно включить автоматический выбор скорости регистрации (по умолчанию он включен). При этом скорость регистрации программа выбирает в соответствии с продолжительностью эксперимента и максимальным количеством регистрируемых точек. Автоматическая скорость регистрации рассчитывается по времени работы режима при условии заполнения половины массива данных (40000 точек на массив). При работе в режиме развертки напряжения программа выбирает скорость регистрации таким образом, чтобы регистрировать данные через каждые ~4 мВ развертки. Следует отметить, что при понижении скорости регистрации точность измерений растет, так как при этом прибор производит усреднение данных, поступающих с АЦП, всегда работающего на максимальной скорости регистрации. При работе с низкими токами и большими скоростями регистрации (близкими к максимальным) управляющая программа не может произвести фильтрацию наводок и шумов, поэтому качество экспериментальных данных при этом будет определяться помехозащищенностью всей установки, т.е. помехозащищенностью образца и адекватностью выбора диапазонов тока и напряжения.
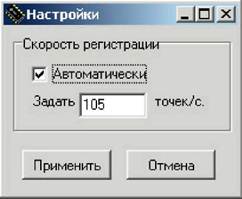
Рис. 6. Окно установки скорости регистрации точек
Примечание:
Рекомендуется использовать ручной режим задания скорости регистрации, ввиду того, что это позволяет произвести фильтрацию и усреднение точек на стадии записи данных и, тем самым, снизить регистрируемые помехи и наводки, благодаря тому, что далеко не во всех случаях требуется заполнять весь массив данных (40 тыс. точек, как это делает автоматический режим задания скорости регистрации).
Если после запуска режима программа долго не отвечает, либо долго находится на стадии соединения с прибором или загрузки калибровок, а данные при этом не регистрируются, то, вероятно, произошел сбой в передаче данных. Рекомендуется снять программу с выполнения в меню “Пуск” Вашей операционной системы, выключить и включить прибор заново, перезапустить программу.
Рабочее окно программы PS_Pack (рис. 3) можно условно поделить на две части. На правой части представлены основные пять режимов работы прибора:
- вольтметр;
- потенциостат;
- гальваностат;
- развертка потенциала (тока);
- специальная развертка потенциала.
Перед началом запуска измерения необходимо ввести числовые величины в информационные поля описания режима, установив длительность проведения измерения (и ее размерность!). Запуск необходимого режима осуществляется нажатием кнопки «Старт», расположенной в соответствующей рабочей области, после чего программа проверяет введенные данные и при необходимости исправляет их или выводит сообщения об ошибках. При запуске выбранного режима (нажатием кнопки «Старт» после введения всех рабочих параметров) программа соединяется с прибором, загружает калибровки, выполняет рабочую программу, отключает прибор. При этом в поле “Сообщения” выводится информация о работе прибора – выполнение необходимых процедур и наличие перегрузок.
Внимание!
Во время работы прибора настоятельно НЕ рекомендуется работать на ПК с другими приложениями (рекомендуется закрыть все остальные программы) и изменять величины в меню управляющей программы, так как это может привести к потере или искажению данных.
Для экстренной остановки работы прибора до окончания измерения можно нажать кнопку «Стоп», не дожидаясь автоматической остановки.
Основные режимы работы потенциостата
- вольтметр; - потенциостат; - гальваностат;Сохранение и перенос данных в MS Excel.
Создайте документ MS Excel и откройте его. Выберите файл измерения, которое необходимо перенести в Книгу Excel. Выделите всё в текстовом файле и… Из-за особенностей программного обеспечения потенциостата числовые значения не… Если в настройках Excel в качестве разделителя десятичной части числа выбрана запятая, то необходимо произвести замену…Методика проведения эксперимента
В работе используется электрохимическая стеклянная ячейка ЯЭС-1. Рабочий электрод (РЭ) – никелевая пластина размером 1х1 см (S = 2 см2). Вспомогательный электрод (ВЭ) – платиновая проволока.Оформление результатов исследований
Таблица ... Результаты поляризационных измерений Температура раствора, °С …………………………………………Контрольные вопросы
1. Стадии электрохимической реакции, потенциалопределяющая стадия.
2. Распределение концентрации у поверхности электрода при равновесном потенциале и под током. Основные потоки массопереноса. стр. 147-152.
3. Вывод уравнения поляризационной кривой при стационарной диффузии в случае восстановления катиона металла до металла. стр. 153-157.
4. Предельный ток. Влияние на него концентрации реагирующих ионов, температуры, перемешивания и концентрации фонового электролита.
Рекомендуемая литература
1. Дамаскин Б.Б., Петрий О.А. «Введение в электрохимическую кинетику» Высшая школа, 1983, с. 143-147.
Работа 2. Перенапряжение при выделении водорода
1. Вывод уравнения поляризационной кривой при замедленной стадии разряда Катодное выделение водорода из растворов электролитов на металлических электродах протекает при потенциалах более…Экспериментальная часть
Цель работы: исследование влияния состава раствора, материала катода и плотности тока на перенапряжение выделения водорода.
Электрическую схему установки собирают в соответствии с рис. 4. Исследуемый раствор заливают в электролитическую ячейку. На платиновый катод осаждают путем электролиза слой исследуемого металла толщиной 5-10 мкм (или используют чистую платину по указанию преподавателя). Затем катод тщательно промывают и помещают в ячейку. Поляризацию электрода проводят в соответствии с заданием. По полученным результатам строят поляризационные кривые в координатах потенциал (В) – плотность тока, а также перенапряжение – логарифм плотности тока (А/см2). Находят по полулогарифмической поляризационной кривой постоянную «a» формулы Тафеля, а по наклону кривой определяют коэффициент «b».
η = a + b∙lgiK,
где η – перенапряжение, В;
iK – плотность тока, А/см2;
a, b – константы, «a» зависит от типа катода,
«b» при t = 20 °C ~0,1-0,14 В.
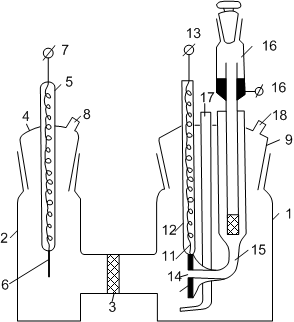
Рис. 4. Электролитическая ячейка:
1 – стеклянный сосуд для исследуемого электрода; 2 – стеклянный сосуд для вспомогательного электрода; 3 – стеклянная трубка, соединяющая электродные пространства; 4 – стеклянная пробка для вспомогательного электрода; 5 – стеклянная трубка для впая платины; 6 – платиновая проволока; 7 – медный провод; 8 – трубка для отвода газа; 9 – стеклянная пробка для исследуемого электрода; 10 – платиновая пластинка; 11 – платиновая проволока; 12 – стеклянная трубка для впая платины; 13 – медный провод; 14 – отверстие в платиновой пластине; 15 – стеклянная трубка – электролитический ключ; 16 – электрод сравнения; 17 – стеклянная трубка для подвода газа к исследуемому электроду; 18 – стеклянная трубка для отвода газа.
Сравнивают значение «a» и «b» для всех изучавшихся процессов электролитического выделения водорода с литературными данными.
Равновесный потенциал водородного электрода ЕР рассчитывают по значению pH исследуемого раствора, измеренному на pH-метре или по активности водородных ионов.
В качестве материала катода используется чистая платина или платина, покрытая медью.
Для осаждения меди на платину используют раствор, содержащий
CuSO4 - 100 г/л, H2SO4 - 100 г/л.
в окне программы в поле «Гальваностат» задают значения силы тока –10 мА, время – 10 минут, и запускают программу нажатием на кнопку «Старт».
Измерения проводятся в одном из следующих растворов:
1) 2 М H2SO4;
2) 2 M NaOH.
Перед поляризацией электрода измеряют стационарный потенциал электрода (программа в режиме «Вольтметр»).
Варианты поляризации электрода:
1. Линейная развертка потенциала от Естац. до -1900 мВ (отн. р.с.э.) со скоростью 5 мВ/с.
2. Линейная развертка тока от 0 до -40 мА со скоростью 0,1 мА/с.
3. Линейная развертка тока от -40 до 0 мА со скоростью 0,1 мА/с.
При работе в режиме развертки потенциала задают параметры программы «Развертка потенциала»:
Стартовый потенциал ____ мВ (измеренное значение Естац.)
Максимальный потенциал –1900 мВ
Минимальный потенциал –1901 мВ
Скорость развертки 5 мВ/с
Количество циклов 1
Направление развертки – (в сторону отрицательных значений)
Тип диаграммы i(E) - ток – потенциал
Диапазон потенциала 15 В, диапазон тока 500 мА.
При работе в гальванодинамическом режиме необходимо в поле программы «Развертка потенциала» поставить флажок в пункте «Гальваностатический режим». В этом случае программа переключается в режим изменения тока.
Для получения кривых i(E) – ток – потенциал необходимо задать следующие параметры программы «Развертка тока»:
| Параметр | Катодная развертка | Анодная развертка |
| Старт. ток | 0 мА | –40 мА |
| Макс. ток | –40 мА | 0,1 мА |
| Мин. ток | –40,1 мА | 0 мА |
| Скорость развертки | 0,1 мА/с | 0,1 мА/с |
| Направление развертки | – | + |
Диапазон потенциала 15 В, диапазон тока 500 мА.
Во всех режимах остановка выполнения программы осуществляется вручную. Скорость регистрации задать 2 точки/с (меню Установки Настройки Скорость регистрации 2 точки/с Применить).
Оформление результатов исследования
Таблица …. Результаты поляризационных измерений Температура раствора, °С……………………Контрольные вопросы
1. Теория замедленной рекомбинации.
2. Уравнение поляризационной кривой при замедленно протекающей стадии переноса электронов (уравнение Фольмера и Фрумкина).
3. Влияние состава раствора, pH, поверхностно-активных веществ и материала катода на перенапряжение при выделении водорода.
4. Расчет потенциала электрода и перенапряжения.
5. Определение констант «a» и «b» в уравнении Тафеля.
6. Расчет токов обмена.
Рекомендуемая литература
1. Антропов Л.И. Теоретическая электрохимия. –М.: Высш. школа, 1984, с. 359-384, 419-449.
2. Дамаскин Б.Б., Петрий О.А. Введение в электрохимическую кинетику. –М.: Высш. школа, 1983.
Работа 3. Определение коэффициентов диффузии ионов и нейтральных молекул с помощью вращающегося дискового электрода
Цель работы: определение коэффициента диффузии по значениям предельной диффузионной плотности тока, найденным с помощью катодных поляризационных измерений на вращающемся дисковом электроде.
Всякая гетерогенная, в том числе и электрохимическая реакция, включает в себя несколько стадий. Характер этих стадий и их число определяются природой реакции и могут также зависеть от условий проведения процесса. Во всех электрохимических реакциях по меньшей мере одна из стадий представляет собой массоперенос вещества – доставку реагирующих частиц к поверхности электрода или отвод с нее продуктов реакции.
Скорость всего многостадийного процесса контролируется скоростью наиболее медленной стадии. Практически для любой электрохимической реакции можно реализовать такие условия, при которых наиболее медленной стадией будет перенос вещества к электроду или от электрода. Осуществление электрохимических реакций в условиях, когда их скорость контролируется скоростью подвода реагирующих ионов или молекул из глубины раствора к поверхности электрода, дает возможность находить численные значения ряда параметров (концентрацию и коэффициент диффузии реагирующих частиц, число электронов, участвующих в реакции) и характеризовать режим движения жидкости относительно электрода.
В общем случае перенос вещества к электроду или от него осуществляется сочетанием следующих процессов:
1) молекулярной диффузией при возникновении разности концентрации (точнее – активности) вещества в растворе,
2) миграцией ионов под действием электрического поля в растворе,
3) естественным или принудительным размешиванием жидкости, когда частицы, находящиеся в растворе, увлекаются жидкостью и переносятся вместе с ней.
Миграция, естественно, не принимает участия в переносе незаряженных молекул. При переносе вклад миграции пренебрежимо мал, если помимо ионов, которые восстанавливаются или окисляются на электроде, раствор содержит в большом избытке другие виды ионов.
В настоящее время нет точного решения задачи о подводе вещества всеми тремя способами для электродов различной формы. Уравнения конвективной диффузии имеют наиболее простой вид, когда поверхностью электрода служит вращающийся диск.
Проследим движение жидкости к поверхности вращающегося диска. Вдали от электрода жидкость движется вертикально в направлении к диску, как это видно из рис. 1.В тонком же слое жидкости, непосредственно прилегающем к поверхности, она приобретает вращательное движение, причем угловая скорость движения жидкости в тонком приэлектродном слое увеличивается по мере приближения к диску вплоть до значения, равного угловой скорости самого диска. Кроме того, благодаря центробежной силе жидкость приобретает также и радиальную скорость. Эти два эффекта складываются таким образом, что задачу о конвективной диффузии можно решить до конца. Плотность диффузионного потока к вращающемуся дисковому электроду можно описать уравнением:
j = 0,62 ∙ D2/3 ∙ ν–1/6 ∙ ω1/2 ∙ (c0 – cS),
где j – плотность диффузионного потока, моль/(см2∙с);
D – коэффициент диффузии реагирующих частиц, см2/с;
ν – кинематическая вязкость жидкости, см2/с;
ω – угловая скорость вращения (2πN/60, N – число оборотов в минуту);
c0 – объемная концентрация реагирующих частиц, моль/см3;
cS – концентрация реагирующих частиц на внешней (со стороны раствора) границе двойного электрического слоя (при рассмотрении явления переноса вещества к электроду или от него концентрацию cS часто называют поверхностной концентрацией, которую не следует смешивать с концентрацией частиц, адсорбированных на поверхности электрода), моль/см3.
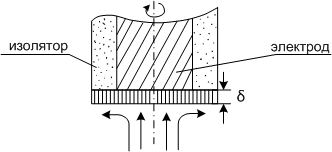
Рис. 1. Вращающийся дисковый электрод.

Рис. 2. Общий вид установки с вращающимся электродом.
1 – вращающийся электрод; 2 – токоподвод; 3 – тахометр; 4 – электромотор
Соответственно, плотность тока на вращающемся дисковом электрода:
i = 0,62 ∙ n∙F∙D2/3 ∙ ν–1/6 ∙ ω1/2 ∙ (c0 – cS),
где i – плотность тока, А/см2;
n – число электронов, участвующих в реакции;
F – число Фарадея, равное 96500 Кл/моль.
Увеличение скорости данной электрохимической реакции возможно лишь до некоторой величины, отвечающей предельной плотности диффузионного потока:
jпр. = 0,62 ∙ D2/3 ∙ ν–1/6 ∙ ω1/2 ∙ c0,
iпр. = 0,62 ∙ n∙F∙D2/3 ∙ ν–1/6 ∙ ω1/2 ∙ c0,
где jпр. и iпр. – соответственно предельная плотность потока и предельная плотность тока.
Скорость реакции связана с плотностью диффузионного потока соотношением:
i = j∙n∙F,
где n – число электронов;
F – постоянная Фарадея.
Увеличение скорости реакции возможно лишь до некоторой величины, отвечающей предельной плотности диффузионного потока:
Методика проведения эксперимента
Дисковый электрод представляет собой металлический стержень диаметром 5 мм, впрессованный в оболочку из тефлона. Перед каждым опытом поверхность… К этому времени ячейка (рис. 3) и раствор должны быть подготовлены к… В исследуемом растворе снимают кривые при 3-4 скоростях вращения диска (в диапазоне от 360 до 1300 об/мин). Кроме…Проведение измерений на потенциостате
б) Измерения проводят в гальванодинамическом режиме. Для этого в поле программы «Развертка потенциала» поставить флажок «Гальваностатический режим».… Скорость регистрации задать 5 точек в секунду (меню Установки Настройки…Оформление результатов исследования
2. Результаты пересчета поляризационных кривых свести в таблицу по форме: Таблица … Результаты пересчета поляризационных кривыхКонтрольные вопросы
1. Первый закон Фика. Распределение концентрации ионов в приэлектродном слое.
2. Теория конвективной диффузии.
3. Изменение толщины диффузионного слоя с течением времени и при увеличении плотности тока.
4. Предельный ток. Влияние на него концентрации разряжающихся ионов и ионов фона, температуры, перемешивания и свойств растворителя.
5. Вращающийся дисковый электрод. Уравнение для предельной плотности тока.
6. Вывод и анализ уравнения поляризационной кривой для случая диффузионного перенапряжения в сочетании диффузионного перенапряжения с замедленным разрядом ионов.
7. Методы снятия поляризационных кривых.
Рекомендуемая литература
1. Антропов Л.И. Теоретическая электрохимия. –М.: Высш. школа, 1984, с. 313-314.
2. Дамаскин Б.Г., Петрий О.А. Введение в электрохимическую кинетику. –М.: Высш. школа, 1983, с. 168-173.
Работа 4. Исследование нестационарной диффузии хронопотенциометрическим методом
Хронопотенциометрия – метод исследования электрохимических процессов, основанный на определении зависимости потенциала от времени при постоянной… Рассмотрим самый простой вариант хронопотенциометрического метода – так…Экспериментальная часть
Цель работы: измерение коэффициентов диффузии ионов, суммарного числа электронов катодной реакции и определение природы лимитирующей стадии.
Схема для получения хронопотенциограмм состоит из следующих основных элементов (см. рис. 3): ячейки (1) с рабочим (2) и вспомогательным (3) электродами и электродом сравнения (4); потенциостата (5).
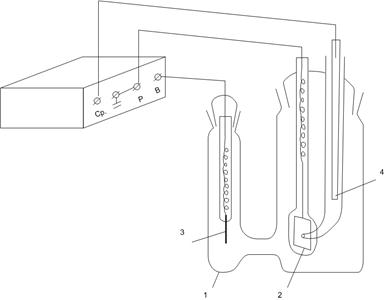
Рис. 3. Схема установки для снятия кривых E – t:
1 – ячейка с исследуемым раствором; 2 – рабочий электрод; 3 – вспомогательный электрод; 4 – электрод сравнения; 5 – потенциостат.
Получают катодные гальваностатические кривые потенциал – время (хронопотенциограммы) для электрохимических реакций, скорость которых определяется скоростью стадии диффузии реагирующих частиц к поверхности электрода. В качестве исследуемых систем используют по указанию преподавателя один из растворов:
1. K3[Fe(CN)6] – 0,02 M,
K4[Fe(CN)6] – 0,02 M,
KOH – 1 M. Материал рабочего электрода – платина
2. CuSO4 – 0,025 М,
H2SO4 – 1 M . Материал рабочего электрода – медь (платина, покрытая медью).
Меднение платины: CuSO4 – 200 г/л, H2SO4 – 100 г/л, 10 мА, 10 минут.
Из гальваностатических кривых E-t определяют переходное время τ, рассчитывают произведение i∙τ1/2 и коэффициент диффузии восстанавливающихся ионов (Cu2+, Zn2+).
Строят хронопотенциограммы в координатах E – lg (1 – t1/2/τ1/2), определяют их наклон и рассчитывают число электронов n.
После проверки схемы и ознакомления с работой потенциостата работа выполняется в следующем порядке:
1. Подготовить к работе рабочий электрод.
Для осаждения меди на поверхность платины собирают ячейку, в которой рабочим электродом будет гладкая платина. Электроды подключают по двухэлектродной схеме: клеммы work+comp подсоединяют к рабочему электроду, counter+ref – к вспомогательному электроду. В программе в поле «Гальваностат» задают силу тока -10 мА (минус), время работы 10 минут. Нажатием на кнопку «Старт» запускают программу. Через 10 минут ячейка выключится. Рабочий электрод после нанесения покрытия промывают сначала водопроводной, затем дистиллированной водой и помещают в ячейку для снятия поляризационной кривой. После этого подключают электрод к потенциостату и измеряют стационарный потенциал рабочего электрода в отсутствие внешнего тока (Work+Comp – к рабочему электроду, Ref – к электроду сравнения, Counter – к вспомогательному электроду).
2. Снимают поляризационную кривую в исследуемом растворе при линейной развертке поляризующего тока со скоростью υi = 0,03 мА/с. В поле «Развертка потенциала» поставить флажок «Гальваностатический режим» - программа переключается в режим развертки тока. Задают:
Старт. ток 0 мА
Макс. ток –5 мА
Мин. ток –5,1 мА
Скорость развертки 0,03 мА/с
Направление развертки – (в сторону отрицательных значений)
Количество циклов 1
Остановка выполнения программы осуществляют вручную нажатием на кнопку «Стоп» при обнаружении резкого изменения потенциала (достижение предельного тока).
Из полученной поляризационной кривой определяют величину стационарного предельного диффузионного тока восстанавливающихся ионов. Рассчитывают величины токов гальваностатических кривых, которые превышают предельный диффузионный ток на 25, 50, 75, 100 и 125%.
3. Обновляют поверхность электрода вышеуказанным способом и приступают к съемке гальваностатических кривых в исследуемом растворе.
В поле программы «Гальваностат» задать требуемое значение тока (iпр.∙1,25; iпр.∙1,50; iпр.∙1,75 и т.д.) (со знаком минус) и время измерения 2 мин. Выбрать тип диаграммы E(t) – потенциал – время. Время измерения 2 минуты задается с запасом, поэтому, когда потенциал электрода перестанет сильно изменяться, остановить программу вручную. Сохранить полученные данные. Повторить измерения при большей силе тока.
Обработка результатов
Три хронопотенциограммы, снятые при наименьшей, средней и наибольшей плотностях тока, строят в координатах E – lg (1 – t1/2/τ1/2). Определяют…Оформление результатов исследования
2. Хронопотенциограммы построить в единой системе координат, пересчитав значения потенциала относительно водородного электрода (н.в.э.). Результаты… 3. Из полученных хронопотенциограмм определить значения переходного времени… 4. Три хронопотенциограммы, снятые при наименьшей, средней и наибольшей плотностях тока, построить в координатах E –…Контрольные вопросы
1. Распределение концентрации в приэлектродной зоне раствора при гальваностатически условиях нестационарной диффузии к плоскому электроду.
2. Изменение эффективной толщины диффузионного слоя и концентрации реагирующего вещества у поверхности электрода с течением времени.
3. Переходное время – связь с изменением концентрации у поверхности электрода и электродного потенциала.
4. Уравнение Караогланова.
5. Установление диффузионной природы лимитирующей стадии методом анализа хронопотенциограмм.
Рекомендуемая литература
1. Антропов Л.И. Теоретическая электрохимия. –М.: Высш. школа, 1984, с. 146-149, 303-319.
2. Дамаскин Б.Г., Петрий О.А. Введение в электрохимическую кинетику. –М.: Высш. школа, 1983, с. 147-152, 211-216.
– Конец работы –
Используемые теги: теоретической, электрохимии0.053
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: По Теоретической электрохимии
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов