рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Цикл Карно с идеальным газом
Реферат Курсовая Конспект
Цикл Карно с идеальным газом
Цикл Карно с идеальным газом - раздел Образование, Изохорный процесс Основываясь На Втором Начале Термодинамики, Карно Вывел Теорему: Из Всех Пери...
Основываясь на втором начале термодинамики, Карно вывел теорему: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т1) и холодильников (Т2), наибольшим кпд обладают обратимые машины; при этом кпд обратимых машин, работающих при одинаковых температурах нагревателей (Т1) и холодильников (Т2), равны друг другу и не зависят от природы рабочего тела (тела, совершающего круговой процесс и обменивающегося энергией с другими телами), а определяются только температурами нагревателя и холодильника.
 Карно проанализировал обратимый цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Карно проанализировал обратимый цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
 Изотермические расширение и сжатие заданы соответственно кривыми 1—2 и 3—4, а адиабатические расширение и сжатие — кривыми 2—3 и 4—1. При изотермическом процессе U= const, поэтому, количество теплоты Q1 полученное газом от нагревателя, равно работе расширения совершаемой газом при переходе из состояния 1 в состояние 2 (1):
Изотермические расширение и сжатие заданы соответственно кривыми 1—2 и 3—4, а адиабатические расширение и сжатие — кривыми 2—3 и 4—1. При изотермическом процессе U= const, поэтому, количество теплоты Q1 полученное газом от нагревателя, равно работе расширения совершаемой газом при переходе из состояния 1 в состояние 2 (1):
 При адиабатическом расширении 2—3 теплообмен с окружающей средой отсутствует и работа расширения совершается за счет изменения внутренней энергии.
При адиабатическом расширении 2—3 теплообмен с окружающей средой отсутствует и работа расширения совершается за счет изменения внутренней энергии.
Количество теплоты Q2, отданное газом холодильнику при изотермическом сжатии, равно работе сжатия (2):

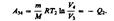 Работа адиабатического сжатия
Работа адиабатического сжатия
Работа, совершаемая в результате кругового процесса

и, как можно показать, определяется площадью, закрашенной на рис. Термический кпд цикла Карно

 Применив уравнение TVγ-1=const для адиабат 2—3 и 4—/, получим
Применив уравнение TVγ-1=const для адиабат 2—3 и 4—/, получим
откуда (3):
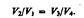
Подставляя формулы (1) и (2) в формулу
 η=A/Q=Q1-Q2/Q1=1-Q2/Q1 и учитывая формулу (3), получаем:
η=A/Q=Q1-Q2/Q1=1-Q2/Q1 и учитывая формулу (3), получаем:
т.е для цикла Карно кпд действительно определяется только температурами нагревателя и холодильника. Обратный цикл Карно положен в основу действия тепловых насосов. Тепловые насосы должны как можно больше тепловой энергии отдавать горячему телу. Теорема Карно послужила основанием для установления термодинамической шкалы температур. Сравнив левую и правую части формулы, получим:

т.е. для сравнения температур Т1 и Т2 двух тел необходимо осуществить обратимый цикл Карно, в котором одно тело используется в качестве нагревателя, другое — холодильника.
88.Свободная энергия. Энтропия – мера технической неполноценности внутренней энергии. dQ=dU+dA (1), TdS=dU+dA (2) => пусть в системе происходит изотермический процесс T=const: dA=TdS-dU=-d(U-TS) (3), F=U-TS – свободная энергия dA=-dF (4). Из (4) следует, что свободная энергия идет на совершение работы, которую может произвести система при изотермическом процессе. TS – связанная энергия в работу не превращается. Поэтому S называют мерой технической неполноценности внутренней энергии.
– Конец работы –
Эта тема принадлежит разделу:
Изохорный процесс
Диаграмма этого процесса изохора в координатах p V изобр ся прямой параллельной оси ординат... Q dU A pdV gt A... Удельная теплоемкость равна кол ву теплоты которое небход Затратить для нагрев кг вещ ва на К...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Цикл Карно с идеальным газом
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов