рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Химическое равновесие в неидеальных системах
Реферат Курсовая Конспект
Химическое равновесие в неидеальных системах
Химическое равновесие в неидеальных системах - раздел Химия, ФИЗИЧЕСКАЯ ХИМИЯ Закон Действующих Масс (V, 5) Применим, Как Уже Говорилось, Лишь К Идеальным ...
Закон действующих масс (V, 5) применим, как уже говорилось, лишь к идеальным газам (или идеальным растворам). Для таких систем произведение равновесных относительных парциальных давлений реагирующих веществ, равное K0, не зависит от общего давления. Применение этого закона к реальным системам неизбежно носит приближенный характер, при этом неточность закона должна возрастать с увеличением давления и понижением температуры.
Ниже дан пример зависимости «константы» равновесия реакции N2 + 3H2 « 2NH3 от давления (при t = 450°C):
| Р, атм. | |||||||

| 6,55×10-3 | 6,71×10-3 | 6,85×10-3 | 7,20×10-3 | 8,77×10-3 | 12,8×10-3 | 22,8×10-3 |
Из приведенных данных следует, что при изменении давления в системе от 10 до 1000 атм. «константа» изменяется почти в четыре раза, что связано с отклонением поведения реальных газов от идеальности.
Свойства реального газа существенно зависят от межмолекулярных взаимодействий. В обычных условиях, когда средняя потенциальная энергия взаимодействия молекул намного меньше их средней кинетической энергии, свойства реального газа незначительно отличаются от свойств идеального газа. Отличие свойств реального газа от свойств идеального газа становится особенно значительным при высоких давлениях и низких температурах.
Принципиально возможны два способа изучения равновесия в реальных системах.
Первый основан на использовании вместо закона идеального газа уравнения состояния реального газа (например, уравнения Ван-дер-Ваальса или какого-либо другого). А именно, в дифференциал dG = VdP можно подставить V или dP, определенные из выбранного уравнения состояния, и далее вывести закон равновесия, заменяющий закон действующих масс. Этот путь использовался и оказался неудачным. Во-первых, любое уравнение состояния является приближенным и бóльшая точность связана с бóльшей сложностью уравнения. Во-вторых, само выражение закона зависело бы от выбранного в достаточной степени произвольно уравнения состояния. Таким образом, было бы неизбежно появление различных законов равновесия в зависимости от вкуса и требований автора, не говоря уже о математических сложностях, связанных с их выводом.
Иной путь решения задачи предложил Гилберт Льюис, который ввел в термодинамику понятия фугитивности (летучести) f и активности a.
Фугитивность — величина, не имеющая определенного физического смысла, но будучи подставленной в термодинамические уравнения, выведенные для идеального газа, она делает их пригодными для реального газа. По этой причине фугитивность иногда называют исправленным давлением.
Хотя этот прием является формально-математическим, однако он, бесспорно, оказался удобным и продуктивным.
Таким образом, фугитивность (летучесть) — термодинамическая величина, которая служит для записи зависимости химического потенциала индивидуальных веществ или компонентов смеси от параметров состояния (давления, температуры и состава).
Для индивидуального (реального) газа фугитивность f (T,P) определяется соотношением:
 (V, 19)
(V, 19)
где μ(T, Р) — химический потенциал вещества, μ0(T) — его стандартный химический потенциал, равный химическому потенциалу в некотором гипотетическом состоянии, в котором при данной температуре и давлении равном 1атм., газ обладал бы свойствами идеального газа;  — относительная фугитивность вещества; R — универсальная газовая постоянная. Кроме фугитивности чистого вещества, определяемой соотношением (V, 18), для реальных газовых смесей вместо парциального давления вводят также парциальную фугитивность. Делается это с помощью выражения (III, 52) для химического потенциала компонента в смеси (парциального мольного изобарного потенциала):
— относительная фугитивность вещества; R — универсальная газовая постоянная. Кроме фугитивности чистого вещества, определяемой соотношением (V, 18), для реальных газовых смесей вместо парциального давления вводят также парциальную фугитивность. Делается это с помощью выражения (III, 52) для химического потенциала компонента в смеси (парциального мольного изобарного потенциала):
 (V, 20)
(V, 20)
где  — число молей компонентов смеси, кроме i-ого компонента;
— число молей компонентов смеси, кроме i-ого компонента;  — относительная парциальная фугитивность.
— относительная парциальная фугитивность.
Из приведенного определения фугитивности следует, что она измеряется в единицах давления. Стандартное состояние в выражениях (V, 19) и (V, 20) относится к P0 = ¦0 = 1атм.
Так как с понижением давления поведение газа приближается к идеальному, то в пределе

Широко применяется понятие коэффициента фугитивности (летучести), определяемого соотношением:
 (V, 21)
(V, 21)
Коэффициент фугитивности (летучести) характеризует степень отклонения газа от идеального, это безразмерная величина. Его численное значение может быть и меньше, и больше единицы. В пределе, когда Р стремится к нулю, коэффициент γ стремится к единице:

Перейдем к описанию химического равновесия в реальных системах. На основе общего условия равновесия реакции (IV, 11), т. е.  , а также выражения химического потенциала в форме (V, 20), можем вывести уравнение изотермы реакции в реальной газовой смеси, по форме совпадающее с уравнением изотермы Вант‑Гоффа, т. е.
, а также выражения химического потенциала в форме (V, 20), можем вывести уравнение изотермы реакции в реальной газовой смеси, по форме совпадающее с уравнением изотермы Вант‑Гоффа, т. е.
 (V, 22)
(V, 22)
где (DGT) — изменение изобарного потенциала, соответствующее одному пробегу реакции при условии постоянства исходных значений фугитивностей  , стоящих во втором слагаемом справа. В первом слагаемом значения фугитивностей
, стоящих во втором слагаемом справа. В первом слагаемом значения фугитивностей  соответствуют равновесному состоянию.
соответствуют равновесному состоянию.
На основании (V, 22) также можно записать закон действующих масс для реальной системы, по форме совпадающий с (V, 5):

Если воспользоваться определением коэффициента фугитивности (летучести) (V, 21), то константу равновесия можно представить в таком виде:
 (V, 23)
(V, 23)
где вводится обозначение  .
.
Здесь использовано прежнее обозначение K0 и введено новое Kg. Важно понять, что величина Kg в реальных системах не является константой, она зависит от давления. При расчетах равновесий в реальных системах чаще всего поступают так: определяют K0 для достаточно низких давлений, когда Kg » 1. Затем для заданных давления и температуры находят коэффициенты фугитивности и по соотношению (V, 23) определяют значение K0 для этих условий. Далее, считая применимым закон Дальтона, вычисляют, как уже описано, равновесную степень превращения и состав равновесной смеси.
Равным образом вместо константы равновесия Kc для реальной системы следует записать
 ,
,
где a — активность компонента, заменяющая его концентрацию в реальной смеси в выражении (III, 54), т. е.

В таком виде уравнение химического потенциала используется и для компонентов жидкого раствора.
По аналогии с коэффициентом фугитивности вводится понятие коэффициента активности, характеризующего степень отклонения раствора от идеального,

§ 10. Методы расчета фугитивности (летучести)
Чтобы вычислить фугитивность, необходимо знать явную зависимость её от давления при постоянной температуре.
Энергия Гиббса как функция давления и температуры определяется по уравнению (III, 31):
dG = – SdT + VdP
Тогда при T = const оно сводится к виду dG =VdP.
Интегрирование этого уравнения для одного моля вещества дает следующий результат:

Если P1®0, то свойства газа приближаются к свойствам идеального газа, т. е.  . Опуская индекс «2», в этом случае можем записать:
. Опуская индекс «2», в этом случае можем записать:
 , (V, 24)
, (V, 24)
(с учетом выражения Vид. для одного моля идеального газа из уравнения Менделеева‑Клапейрона).
Если принять во внимание, что для одного моля вещества в газообразном состоянии
 (V, 25)
(V, 25)
то подставив из (V, 19) и (III, 52) значения химического потенциала для реального и идеального газов, получим:
 (V, 26)
(V, 26)
Из сравнения уравнений (V, 24), (V, 25) и (V, 26)следует, что

Или после простых преобразований:
 (V, 27)
(V, 27)
Разность  — это так называемая объемная поправка неидеального газа, учитывающая, что объем реального газа отличается от объема идеального газа.
— это так называемая объемная поправка неидеального газа, учитывающая, что объем реального газа отличается от объема идеального газа.
С учетом введенного обозначения уравнение (V, 27) можно переписать следующим образом:
 (V, 28)
(V, 28)
Полученное уравнение позволяет вычислять коэффициенты фугитивности (летучести) по экспериментальным данным. Величину интеграла находят графически по площади под кривой a = a(P) (смотри рис.22). При приближении кривой к значению Р = 0 ее приходится экстраполировать, что не представляет затруднений ввиду линейного хода кривой в области малых давлений. Представленный на рисунке график относится к водороду. Для абсолютного большинства других газов разность  стремится к нулю при
стремится к нулю при  , а при высоких давлениях значение a может принимать отрицательные значения.
, а при высоких давлениях значение a может принимать отрицательные значения.

Рис. 22. К графическому определению летучести газа по зависимости объемной поправки неидеального газа от давления.
Другой графический метод расчета основан на использовании коэффициента сжимаемости. Коэффициентом сжимаемости z называется отношение 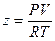 . Очевидно, что для идеального газа его значение равно единице, но отличается от единицы для реальных газов.
. Очевидно, что для идеального газа его значение равно единице, но отличается от единицы для реальных газов.
Если принять во внимание, что

уравнение (V, 28) можно преобразовать к следующему виду:

Полученный интеграл определяют графически по площади под кривой в координатах
(z – 1) – lnP.
Третий метод используют для определения коэффициента фугитивности (летучести) по изотермам идеального и реального газов в координатах P – V от достаточно низкого давления, при котором эти изотермы практически сливаются, до давления, при котором требуется определить фугитивность. Построим изотерму реального газа P = f (V) (кривая «b» на рис.23). Не представляет труда на этом же графике начертить идеальную изотерму  (кривая «а» на рис.23). Выберем два давления P2 и Р1 и проведем соответствующие им изобары. Продифференцируем уравнение(V, 19) при условии T = const:
(кривая «а» на рис.23). Выберем два давления P2 и Р1 и проведем соответствующие им изобары. Продифференцируем уравнение(V, 19) при условии T = const:

Принимая во внимание, что для одного моля газа 
(смотри (III, 32)), получим:
 или, помня о постоянстве температуры, можем записать
или, помня о постоянстве температуры, можем записать

После интегрирования последнего уравнения имеем:

Из геометрических соображений (рис.23) следует, что интеграл  будет равен площади фигуры, ограниченной реальной изотермой, двумя изобарами и осью ординат, т. е. точками 122’1’. Из рисунка также следует, что указанный интеграл можно определить как разность, полученную вычитанием из площади фигуры 133’1’, ограниченной идеальной изотермой, двумя изобарами и осью ординат площади заштрихованной области 233’2’.
будет равен площади фигуры, ограниченной реальной изотермой, двумя изобарами и осью ординат, т. е. точками 122’1’. Из рисунка также следует, что указанный интеграл можно определить как разность, полученную вычитанием из площади фигуры 133’1’, ограниченной идеальной изотермой, двумя изобарами и осью ординат площади заштрихованной области 233’2’.
Площадь фигуры, ограниченной идеальной изотермой, определяется без труда, она равна интегралу

Следовательно,  , где символом «А» мы обозначили площадь заштрихованной области 233’2’.
, где символом «А» мы обозначили площадь заштрихованной области 233’2’.
Если теперь за Р1 принять такое давление, при котором реальная и идеальная изотермы совпадут, что возможно при Р1 ® 0, то летучесть будет равна давлению, т. е. ¦1 = Р1.
В этом случае
 или
или
 ,
,
где символом A* обозначена площадь всей фигуры, находящейся между верхней изобарой и обеими изотермами до точки их слияния.
Опуская индексы, после сокращений получим:

Следовательно, для определения летучести газа при заданном давлении Р нужно измерить площадь, заключенную между двумя изотермами от давления Р до Р = 0 или  . В последнем и заключается неудобство обсуждаемого метода, т. к. трудно строить изотермы в области больших объемов и решить, где же их оборвать. Другой недостаток метода заключается в том, что вычисление площади, ограниченной двумя кривыми, связано с дополнительными погрешностями.
. В последнем и заключается неудобство обсуждаемого метода, т. к. трудно строить изотермы в области больших объемов и решить, где же их оборвать. Другой недостаток метода заключается в том, что вычисление площади, ограниченной двумя кривыми, связано с дополнительными погрешностями.

Рис. 23. Графическое определение летучести газа, где «а» — идеальная изотерма,
«b» — реальная изотерма.
Еще один метод определения фугитивности (летучести) основан на принципе соответственных состояний. Согласно этому принципу при одинаковых приведенном давлении 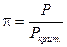 и приведенной температуре
и приведенной температуре 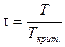 значения коэффициента фугитивности (летучести) для различных веществ должны быть одинаковыми. Из понятия соответственного состояния вытекает, что коэффициент сжимаемости z, который учитывает степень отклонения неидеальных систем от идеальной, в критическом состоянии для всех веществ должен быть одинаков:
значения коэффициента фугитивности (летучести) для различных веществ должны быть одинаковыми. Из понятия соответственного состояния вытекает, что коэффициент сжимаемости z, который учитывает степень отклонения неидеальных систем от идеальной, в критическом состоянии для всех веществ должен быть одинаков:  .
.
В действительности же, его величина зависит от природы вещества. На этом основании составлены таблицы, где при определении значений коэффициентов фугитивности (летучести) учитываются не только приведенные температура и давление, но и различные значения zкрит.. Таким образом, при близости вещества к насыщенному состоянию g = g(p, t, zкрит.).
Зависимость коэффициента фугитивности (летучести) от приведенного давления при различных приведенных температурах может быть представлена на графиках, используемых для тех же определений (смотри рис. 24).

Рис. 24. Зависимость коэффициента летучести γ от приведенного давления π
и приведенной температуры τ.
– Конец работы –
Эта тема принадлежит разделу:
ФИЗИЧЕСКАЯ ХИМИЯ
На сайте allrefs.net читайте: "ФИЗИЧЕСКАЯ ХИМИЯ"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Химическое равновесие в неидеальных системах
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов