рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Механика
- /
- Основные представления и законы молекулярно-кинетической теории
Реферат Курсовая Конспект
Основные представления и законы молекулярно-кинетической теории
Основные представления и законы молекулярно-кинетической теории - раздел Механика, Федеральное агенТство по образованию 1. Идеальный Газ – Это Теоретическая Модель Газа, В Которой: А) Не У...
1. Идеальный газ – это теоретическая модель газа, в которой:
а) не учитывается взаимодействие его частиц (средняя кинетическая энергия частиц намного больше энергии их взаимодействия);
б) принято считать, что размеры молекул идеального газа малы по сравнению с расстояниями между ними;
в) принято считать, что суммарный собственный объем молекул такого газа мал по сравнению с объемом сосуда;
г) принято считать, что силы взаимодействия между молекулами настолько малы, что движение молекул от столкновения до столкновения происходит по прямолинейным отрезкам. Число ежесекундных столкновений молекул мало.
2. Одно из основных положений молекулярно-кинетической теории идеального газа утверждает:
а) газ состоит из мельчайших частиц – атомов или молекул. Молекулы (атомы) газа свободно движутся между двумя последовательными взаимодействиями друг с другом или со стенками сосуда, в котором он находится;
б) газ состоит из мельчайших частиц – атомов или молекул, находящихся в непрерывном движении;
в) газ состоит из мельчайших частиц – атомов или молекул, находящихся в непрерывном движении. Направления и значения скоростей молекул газа самые различные;
г) газ состоит из мельчайших частиц – атомов или молекул, находящихся в непрерывном движении. Направления и значения скоростей молекул газа строго определённые.
3. Одно из основных положений молекулярно-кинетической теории идеального газа утверждает:
а) в любом, даже очень малом объёме, к которому применимы выводы молекулярно-кинетической теории, число молекул очень велико. Размеры молекул соизмеримы с расстояниями между ними;
б) в любом, даже очень малом объёме, к которому не применимы выводы молекулярно-кинетической теории, число молекул очень велико. Размеры молекул малы по сравнению с расстояниями между ними;
в) в любом, даже очень малом объёме, к которому применимы выводы молекулярно-кинетической теории, число молекул очень велико. Размеры молекул малы по сравнению с расстояниями между ними.
4. Одно из основных положений молекулярно-кинетической теории идеального газа утверждает:
а) силы взаимодействия между молекулами, кроме моментов соударения, пренебрежимо малы. Соударения молекул происходят с потерей механической энергии, т.е. по закону абсолютно неупругого взаимодействия;
б) силы взаимодействия между молекулами, кроме моментов соударения, пренебрежимо малы. Соударения молекул происходят без потерь механической энергии, т.е. по закону абсолютно упругого взаимодействия;
в) силы взаимодействия между молекулами в момент соударения пренебрежимо малы. Соударения молекул происходят без потерь механической энергии, т.е. по закону абсолютно упругого взаимодействия;
г) силы взаимодействия между молекулами в момент соударения пренебрежимо малы. Соударения молекул происходят с потерей механической энергии, т.е. по закону абсолютно неупругого взаимодействия.
5. Одно из основных положений молекулярно-кинетической теории идеального газа утверждает:
а) при отсутствии внешних сил молекулы газа распределяются равномерно по всему объёму;
б) под действием внешних сил молекулы газа распределяются равномерно по всему объёму;
в) при отсутствии внешних сил молекулы газа распределяются неравномерно по всему объёму.
6. Основное уравнение молекулярно-кинетической теории газов имеет вид  , где
, где 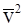 :
:
а) средняя арифметическая скорость молекул газа;
б) средняя квадратичная скорость молекул газа;
в) наиболее вероятная скорость молекул газа.
7. Основное уравнение молекулярно-кинетической теории газов для давления может быть записано в следующем виде:
а)  ;
;
б)  ;
;
в)  .
.
8. Закон Авогадро утверждает:
а) «В одинаковых объемах при разных температурах и давлениях содержатся одинаковые количества молекул»;
б) «В разных объемах при одинаковых температурах и давлениях содержатся одинаковые количества молекул»;
в) «В одинаковых объемах при одинаковых температурах и разных давлениях содержатся одинаковые количества молекул»;
г) «В одинаковых объемах при одинаковых температурах и давлениях содержатся одинаковые количества молекул».
9. Закон Дальтона утверждает:
а) «Давление смеси газов равно сумме тех давлений, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, находился он один»;
б) «Давление смеси газов равно сумме парциальных давлений, т.е. тех давлений, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, находился он один»;
в) «Давление смеси газов равно сумме парциальных давлений, т.е. тех давлений, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, не находился он один».
10. На рисунке 1 в координатах p, V представлены изопроцессы, возможные в идеальных газах. Изотермическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
11. На рисунке 1 в координатах p, V представлены изопроцессы, возможные в идеальных газах. Изобарическому соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
12. На рисунке 1 в координатах p, V представлены изопроцессы, возможные в идеальных газах. Изохорическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
13. На рисунке 1 в координатах p, Т представлены изопроцессы, возможные в идеальных газах. Изотермическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
14. На рисунке 1 в координатах p, Т представлены изопроцессы, возможные в идеальных газах. Изобарическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
15. На рисунке 1 в координатах p, Т представлены изопроцессы, возможные в идеальных газах. Изохорическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
16. На рисунке 1 в координатах V, Т представлены изопроцессы, возможные в идеальных газах. Изотермическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 
|
17. На рисунке 1 в координатах V, Т представлены изопроцессы, возможные в идеальных газах. Изобарическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 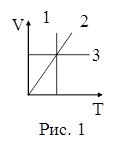
|
18. На рисунке 1 в координатах V, Т представлены изопроцессы, возможные в идеальных газах. Изохорическому процессу соответствует зависимость:
| а) 1; б) 2; в) 3. | 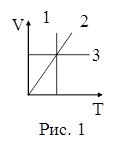
|
19. На рисунке 1 представлена зависимость давления газа от температуры при его нагревании. Сжимался или расширялся газ при нагревании?
| а) сжимался; б) расширялся; в) объём газа не изменялся. | 
|
20. Горелками, дающими за равные промежутки времени одинаковое количество теплоты, нагревались одинаковые массы воды, меди и железа. На рисунке 1 представлены зависимости изменения температуры данных веществ от времени. Изменению температуры воды от времени соответствует график:
| а) 1; б) 2; в) 3. | 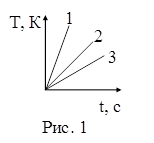
|
21. Горелками, дающими за равные промежутки времени одинаковое количество теплоты, нагревались одинаковые массы воды, меди и железа. На рисунке 1 представлены зависимости изменения температуры данных веществ от времени. Изменению температуры железа от времени соответствует график:
| а) 1; б) 2; в) 3. | 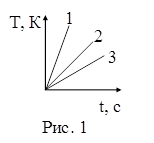
|
22. Горелками, дающими за равные промежутки времени одинаковое количество теплоты, нагревались одинаковые массы воды, меди и железа. На рисунке 1 представлены зависимости изменения температуры данных веществ от времени. Изменению температуры меди от времени соответствует график:
| а) 1; б) 2; в) 3. | 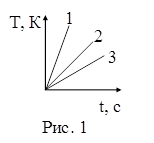
|
23. Уравнение состояния идеальных газов для произвольной массы m (уравнение Менделеева-Клапейрона) имеет вид 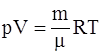 , где R:
, где R:
а) универсальная газовая постоянная, которая численно равна работе расширения газа при его нагревании на один градус в условиях постоянного давления;
б) универсальная газовая постоянная, которая численно равна работе расширения одного моля газа при его нагревании на один градус в условиях постоянного давления;
в) универсальная газовая постоянная, которая численно равна работе расширения одного моля газа при его нагревании до какой-либо температуры в условиях постоянного давления;
г) универсальная газовая постоянная, которая численно равна работе расширения одного моля газа при его нагревании на один градус в условиях изменяющегося давления.
24. Степени свободы i – число независимых координат, необходимых для полного описания состояния движения системы (молекул газа) в пространстве. Все степени свободы:
а) равноправны;
б) не равноправны;
в) постоянны;
г) могут изменяться.
25. Теорема о равномерном распределении энергии по степеням свободы утверждает: «На любую степень свободы одноатомной молекулы приходится в среднем одинаковая энергия, равная  ». Молекула, обладающая i степенями свободы, обладает энергией
». Молекула, обладающая i степенями свободы, обладает энергией  . Из представленных уравнений выберите те, которые полностью соответствуют понятию «степень свободы»:
. Из представленных уравнений выберите те, которые полностью соответствуют понятию «степень свободы»:
а)  ;
;
б)  ;
;
в)  ;
;
г)  .
.
26. В соответствии с теоремой о равномерном распределении энергии по степеням свободы, при температуре идеального газа Т на каждую поступательную степень свободы приходится энергия:
а)  ;
;
б) 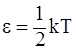 ;
;
в) 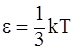 ;
;
г) 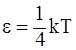 .
.
27. В соответствии с теоремой о равномерном распределении энергии по степеням свободы, при температуре идеального газа Т на каждую вращательную степень свободы приходится энергия:
а)  ;
;
б) 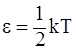 ;
;
в) 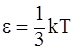 ;
;
г) 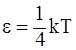 .
.
28. В соответствии с теоремой о равномерном распределении энергии по степеням свободы, при температуре идеального газа Т на каждую колебательную степень свободы приходится энергия:
а)  ;
;
б) 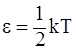 ;
;
в) 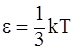 ;
;
г) 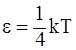 .
.
29. Средняя кинетическая энергия молекулы идеального газа при температуре T равна  , где i = iп + iвр +2 ik. Здесь iп, iвp, ik – число степеней свободы поступательного, вращательного и колебательного движений молекулы. Для гелия (Не) число i равно:
, где i = iп + iвр +2 ik. Здесь iп, iвp, ik – число степеней свободы поступательного, вращательного и колебательного движений молекулы. Для гелия (Не) число i равно:
а) 7;
б) 5;
в) 1;
г) 3.
30. Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. Средняя кинетическая энергия молекул гелия (Не) равна:
а) 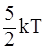 ;
;
б)  ;
;
в)  ;
;
г)  .
.
31. Внутренняя энергия произвольной массы газа m:
а) равна сумме энергий отдельных молекул;
б) не равна сумме энергий отдельных молекул;
в) есть величина постоянная.
32. Теплоемкость – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его до какой-либо температуры;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его на один градус Цельсия;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его на один градус;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его на один градус Кельвина.
33. Удельная теплоёмкость (c) – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус Цельсия;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус Кельвина;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить массе вещества для нагревания её на один градус.
34. Молярная теплоёмкость (C) – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус Цельсия;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус Кельвина;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу, чтобы увеличить его температуру на один градус.
35. Удельная теплоёмкость при постоянном объеме (cv) – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества в условиях постоянного объема;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус Кельвина в условиях постоянного объема;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус Цельсия в условиях постоянного объема;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного объема.
36. Удельная теплоёмкость при постоянном давлении (cp) – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить массе вещества для нагревания её на один градус Цельсия в условиях постоянного давления;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить массе вещества для нагревания её на один градус Кельвина в условиях постоянного давления;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить массе вещества для нагревания её на один градус в условиях постоянного давления;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного давления.
37. Молярная теплоёмкость при постоянном объеме (Cv) – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного объема;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу, чтобы увеличить его температуру на один градус Цельсия в условиях постоянного объема;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу, чтобы увеличить его температуру на один градус Кельвина в условиях постоянного объема;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному грамму вещества, чтобы увеличить его температуру на один градус в условиях постоянного объема.
38. Молярная теплоёмкость при постоянном давлении (Cp) – это:
а) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу, чтобы увеличить его температуру на один градус Цельсия в условиях постоянного давления;
б) физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу, чтобы увеличить его температуру на один градус Кельвина в условиях постоянного давления;
в) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного давления;
г) физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному грамму вещества, чтобы увеличить его температуру на один градус в условиях постоянного давления.
39. Из приведенных формул выберите соотношение, которое соответствует удельной теплоёмкости при постоянном давлении:
а) 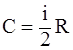 ;
;
б)  ;
;
в) 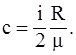 ;
;
г)  .
.
40. Из приведенных формул выберите соотношение, которое соответствует удельной теплоёмкости при постоянном объёме:
а) 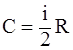 ;
;
б)  ;
;
в)  ;
;
г)  .
.
41. Из приведенных формул выберите соотношение, которое соответствует молярной теплоёмкости при постоянном давлении:
а) 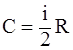 ;
;
б)  ;
;
в)  ;
;
г)  .
.
42. Из приведенных формул выберите соотношение, которое соответствует молярной теплоёмкости при постоянном объёме:
а) 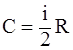 ;
;
б)  ;
;
в)  ;
;
г)  .
.
43. Отношение молярных теплоемкостей g равно:
а)  ;
;
б) 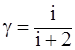 ;
;
в)  ;
;
г)  .
.
44. Отношение удельных теплоемкостей g равно:
а)  ;
;
б) 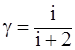 ;
;
в)  ;
;
г)  .
.
45. Отношение молярной теплоёмкости при постоянном давлении Ср к молярной теплоёмкости при постоянном объёме Сv для одноатомных газов:
а) γ ≈ 1,67;
б) γ = 1,40;
в) γ = 1,33;
г) γ = 1,29.
46. Отношение молярной теплоёмкости при постоянном давлении Ср к молярной теплоёмкости при постоянном объёме Сv для двухатомных газов:
а) γ ≈ 1,67;
б) γ = 1,40;
в) γ = 1,33;
г) γ = 1,29.
47. Отношение молярной теплоёмкости при постоянном давлении Ср к молярной теплоёмкости при постоянном объёме Сv для трёхатомных газов:
а) γ ≈ 1,67;
б) γ = 1,40;
в) γ = 1,33;
г) γ = 1,29.
48. Отношение удельной теплоёмкости при постоянном давлении Ср к удельной теплоёмкости при постоянном объёме Сv для одноатомных газов:
а) γ = 1,29;
б) γ = 1,33;
в) γ = 1,40;
г) γ ≈ 1,67.
49. Отношение удельной теплоёмкости при постоянном давлении Ср к удельной теплоёмкости при постоянном объёме Сv для двухатомных газов:
а) γ = 1,29;
б) γ = 1,33;
в) γ = 1,40;
г) γ ≈ 1,67.
50. Отношение удельной теплоёмкости при постоянном давлении Ср к удельной теплоёмкости при постоянном объёме Сv для трёхатомных газов:
а) γ = 1,29;
б) γ = 1,33;
в) γ = 1,40;
г) γ ≈ 1,67.
51. Связь между молярными теплоёмкостями идеального газа отображается уравнением Р. Майера, которое имеет вид:
а)  ;
;
б)  ;
;
в)  ;
;
г)  .
.
52. Молярные теплоемкости гелия в процессах 1 – 2 и 1 – 3 равны C1 и С2 соответственно (рис. 1). Тогда 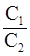 составляет:
составляет:
а)  ;
б) ;
б)  ; ;
| в) 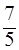 ;
г) ;
г)  . .
| 
|
53. Для газа массой m, находящегося в состоянии равновесия, при T = const, средняя квадратичная скорость молекул, одна из формул которой имеет вид 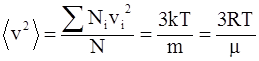 :
:
а) равна нулю;
б) является величиной переменной;
в) остаётся величиной постоянной.
54. Одна из возможных формул наиболее вероятной скорости имеет вид  – это скорость движения молекул, которая характеризует:
– это скорость движения молекул, которая характеризует:
а) распределение молекул в потенциальном силовом поле;
б) положение максимума функции распределения Максвелла;
в) положение максимума функции распределения Больцмана.
55. Одна из возможных формул средней арифметической скорости имеет вид  – это скорость движения молекул, которая характеризует:
– это скорость движения молекул, которая характеризует:
а) распределение молекул в потенциальном силовом поле;
б) положение максимума функции распределения Максвелла;
в) положение максимума функции распределения Больцмана.
56. Относительная скорость применяется для расчета числа молекул, движущихся со скоростями в интервале:
а) от v до v = 0;
б) от v до v – dv;
в) от v до v + dv.
57. Свободные пробеги молекул – это:
а) криволинейные участки траектории, проходимые молекулой между двумя последовательными соударениями;
б) прямолинейные участки траектории, проходимые молекулой между двумя последовательными соударениями;
в) любые участки траектории, проходимые молекулой между двумя последовательными соударениями.
58. Одна из возможных формул для определения средней длины свободного пробега молекулы имеет вид  (где Z – число соударений; <v> – средняя скорость молекулы; k – постоянная Больцмана; <d> – диаметр молекулы; p – давление; T – абсолютная температура) – это:
(где Z – число соударений; <v> – средняя скорость молекулы; k – постоянная Больцмана; <d> – диаметр молекулы; p – давление; T – абсолютная температура) – это:
а) среднее расстояние, проходимое молекулой между двумя соударениями;
б) расстояние, проходимое молекулой между двумя соударениями;
в) среднее расстояние, проходимое молекулой между любыми соударениями.
59. Среднее число соударений, одна из формул для определения которого имеет вид  , – это число соударений молекул <Z>, численно равное:
, – это число соударений молекул <Z>, численно равное:
а) отношению наиболее вероятной скорости движения молекул к средней длине свободного пробега;
б) отношению средней скорости движения молекул к средней длине свободного пробега;
в) отношению средней относительной скорости движения молекул к средней длине свободного пробега;
г) отношению средней квадратичной скорости движения молекул к средней длине свободного пробега.
60. Эффективный диаметр молекулы d – это:
а) средний диаметр молекул газа;
б) минимальное расстояние, на которое сближаются при столкновении центры всех молекул;
в) минимальное расстояние, на которое сближаются при столкновении центры двух молекул.
61. Барометрическая формула  показывает, что давление:
показывает, что давление:
а) убывает с высотой тем быстрее, чем тяжелее газ;
б) убывает с высотой тем быстрее, чем ниже его температура;
в) возрастает с высотой тем быстрее, чем легче газ;
г) не зависит от температуры.
62. Закон распределения молекул газа по высоте в поле сил тяготения (распределение Больцмана) 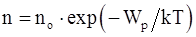 , где no – число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю; n – число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна Wp, показывает, что:
, где no – число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю; n – число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна Wp, показывает, что:
а) концентрация молекул газа увеличивается с увеличением высоты;
б) концентрация молекул газа уменьшается с увеличением высоты;
в) концентрация молекул газа не зависит от высоты.
63. Одна из форм математической записей распределения Максвелла имеет вид  , где
, где  – относительная скорость; v – скорость в данный момент времени; vв – наиболее вероятная скорость, значению которой соответствует максимум кривой Максвелла. Благодаря этому распределению можно определить долю молекул идеального газа, имеющих скорости в интервале:
– относительная скорость; v – скорость в данный момент времени; vв – наиболее вероятная скорость, значению которой соответствует максимум кривой Максвелла. Благодаря этому распределению можно определить долю молекул идеального газа, имеющих скорости в интервале:
а) от v до v = 0;
б) от v до v – dv;
в) от v до v + dv.
64. На рисунке 1 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла). Для этой функции верным утверждением является следующее:
| а) с ростом температуры площадь под кривой растет; б) с ростом температуры величина максимума растет; в) с ростом температуры максимум кривой смещается вправо. | 
|
65. На рисунке 1 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла). Для этого графика верным является соотношение:
а) 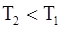 ;
б) ;
б)  ;
в) ;
в)  . .
| 
|
66. На рисунке 1 представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла). Для этой функции верным утверждением является следующее:
| а) с ростом температуры площадь под кривой растет; б) с ростом температуры площадь под кривой уменьшается; в) с ростом температуры площадь под кривой остаётся неизменной. | 
|
67. Зависимость плотности газа от высоты выражается соотношением  , где ρo – плотность газа, где потенциальная энергия молекул равна нулю; ρ – плотность газа в том месте пространства, где потенциальная энергия молекул равна Wp. Оно показывает, что:
, где ρo – плотность газа, где потенциальная энергия молекул равна нулю; ρ – плотность газа в том месте пространства, где потенциальная энергия молекул равна Wp. Оно показывает, что:
а) плотность газа увеличивается с изменением высоты;
б) плотность газа уменьшается с изменением высоты;
в) плотность газа не зависит от высоты.
– Конец работы –
Эта тема принадлежит разделу:
Федеральное агенТство по образованию
Государственное образовательное учреждение... высшего профессионального образования... Курский государственный технический университет...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основные представления и законы молекулярно-кинетической теории
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов